La respuesta RM 4.5 se plantea como nuevo objetivo terapéutico en el tratamiento de la LMC.1 Diversos estudios han demostrado que determinados pacientes en RM 4.5 pueden entrar en la fase de remisión libre de tratamiento (RLT) con éxito.1,2 Así, la RM 4.5 se plantea como objetivo terapéutico más allá de los objetivos habituales en LMC (remisión de la enfermedad, reducción del riesgo de progresión y supervivencia global).1-3
Actualmente, están publicados los resultados de 3 estudios con Tasigna a nivel internacional que evaluaron la RLT en diversas poblaciones de pacientes con LMC.4-6 El desarrollo clínico, que incluyó más de 1000 pacientes, fijó los requisitos necesarios para alcanzar una RLT de manera segura y eficaz.4-6
A continuación se muestran los principales resultados de los estudios de discontinuación con Tasigna y que dieron lugar a la inclusión de los datos en la Ficha técnica:
- ENESTfreedom evaluó la RLT de pacientes que fueron tratados con Tasigna en primera línea a lo largo del tiempo.4
- ENESTop evaluó la probabilidad de RLT en pacientes de LMC tratados con Tasigna en segunda línea.5
- ENESTpath evaluó el tiempo óptimo de consolidación de Tasigna en pacientes con LMC tratados previamente con imatinib, para alcanzar una RLT sin recaídas.6
Dirigido a pacientes con LMC-FC tratados con Tasigna en primera línea.4 Se evaluó el porcentaje de pacientes que mantuvieron una RMM sin recaer a la semana 48 después de entrar en la fase de RLT.4
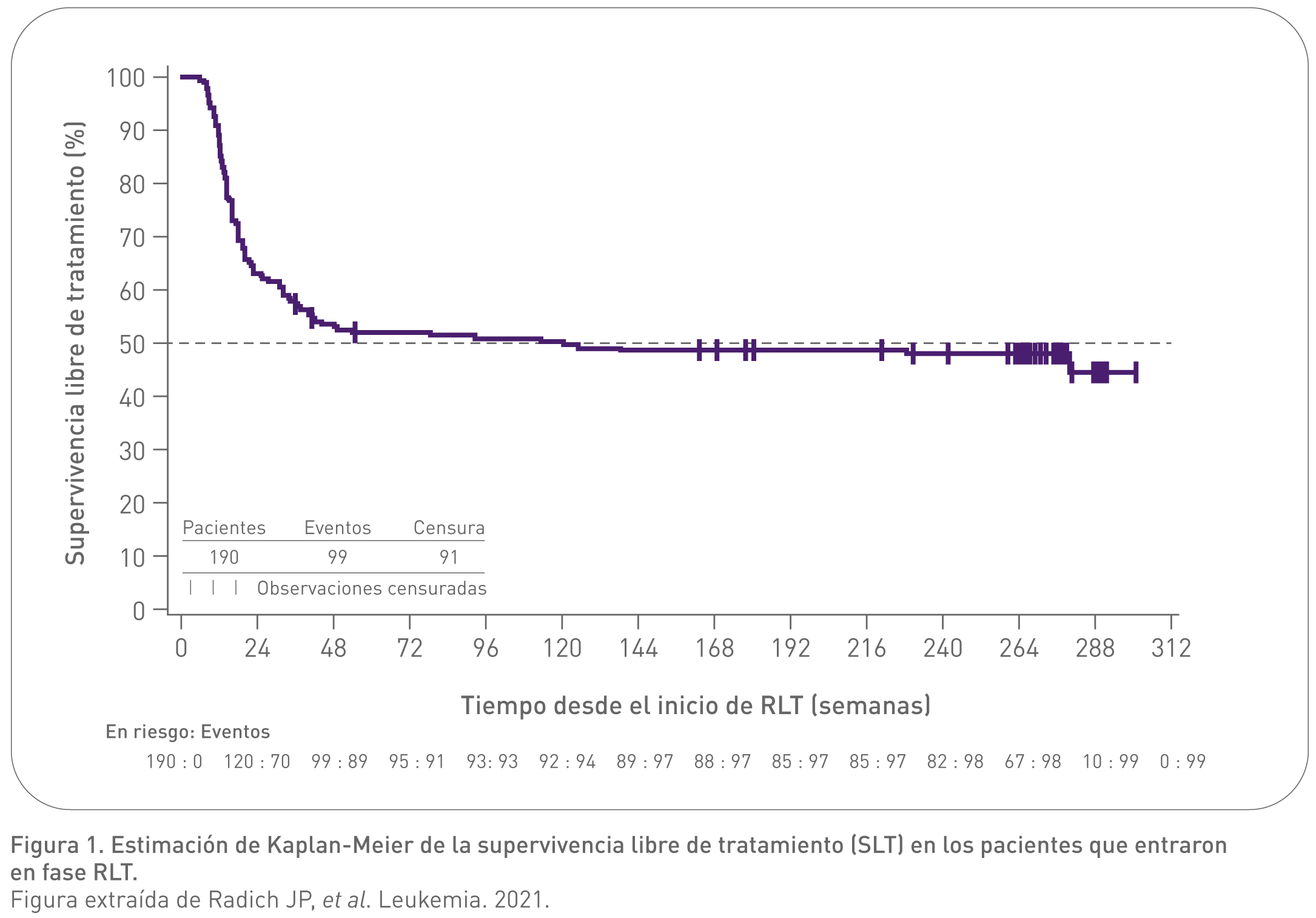
En la actualización a 5 años de seguimiento se evaluaron, de nuevo, los pacientes que se mantuvieron en RLT:7
- El ratio de RLT fue del 51,6% (98/190) a las 48 semanas y 41,6% (79/190) a los 5 años.7
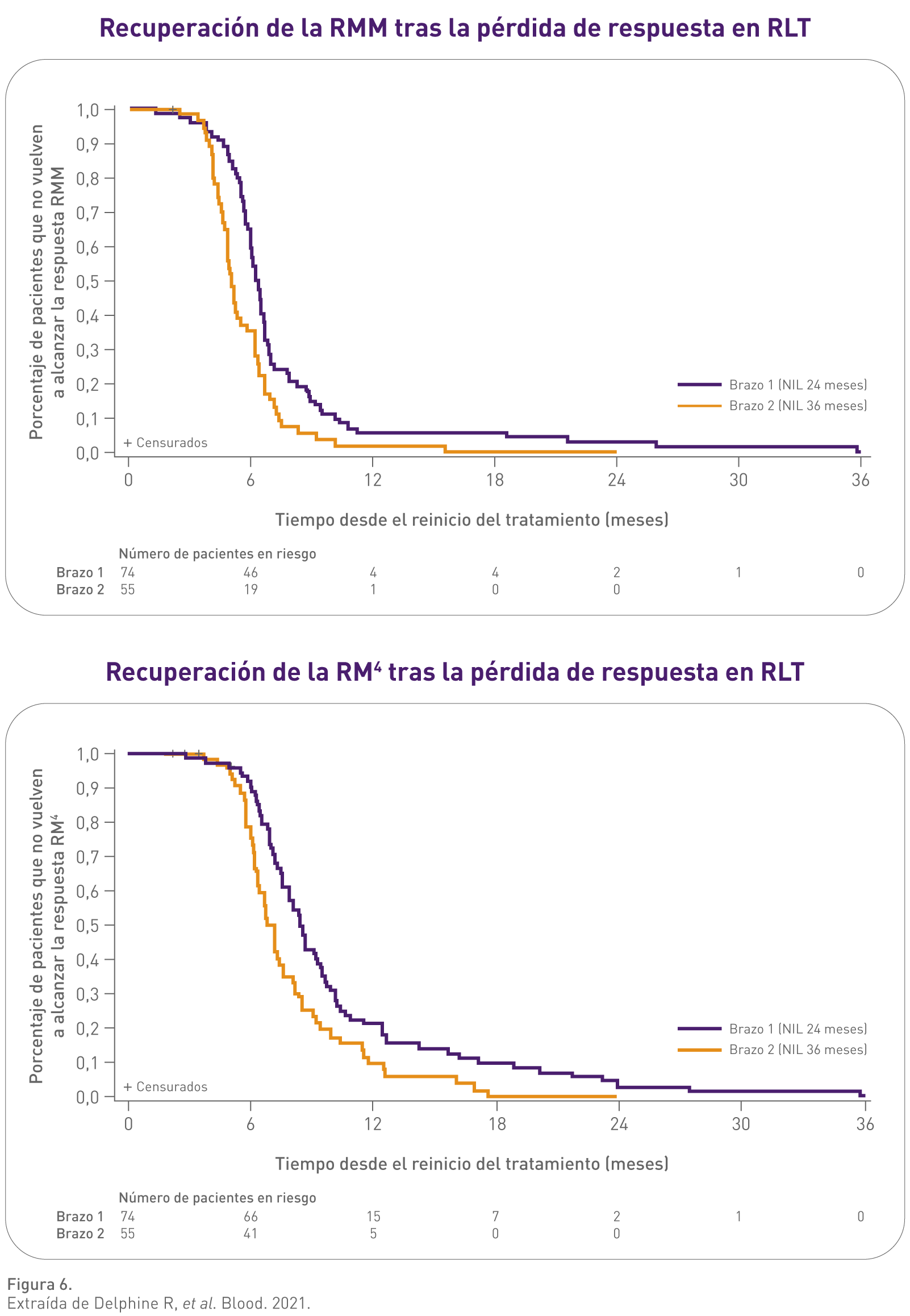
- El 98,9% (90/91) de los pacientes que volvieron a reiniciar el tratamiento con Tasigna alcanzaron de nuevo la RMM.7
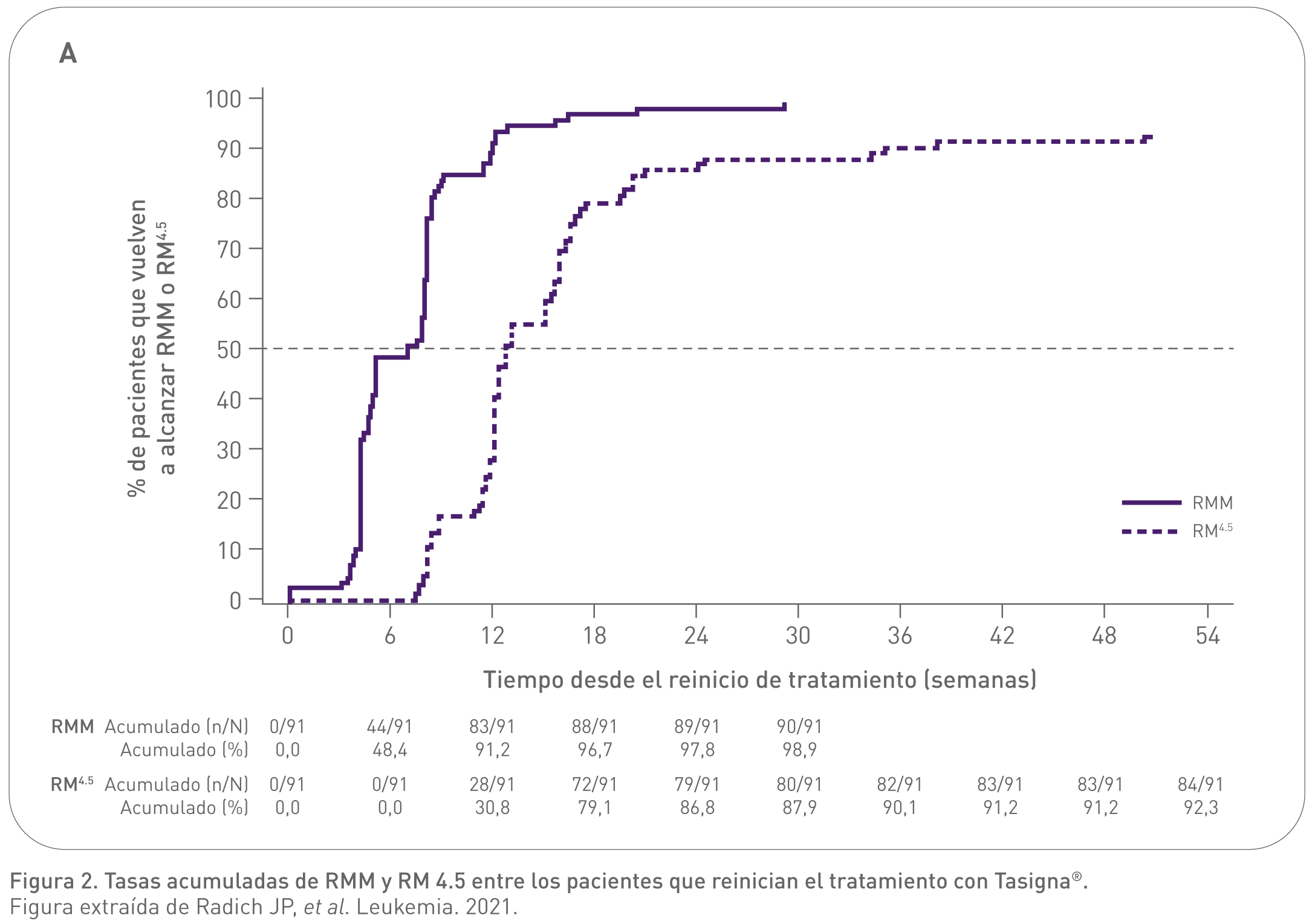
Por tanto, los resultados apoyaban la RLT en los pacientes con respuesta molecular profunda mantenida en tratamiento con Tasigna en primera línea.7
Además, no se observaron nuevos efectos adversos y su frecuencia disminuyó a lo largo de la RLT.7
Puedes acceder al estudio con 5 años de seguimiento haciendo clic aquí.
Dirigido a pacientes con LMC en fase crónica tratados con Tasigna en segunda línea. ENESTop evaluó la RLT a lo largo el tiempo.5
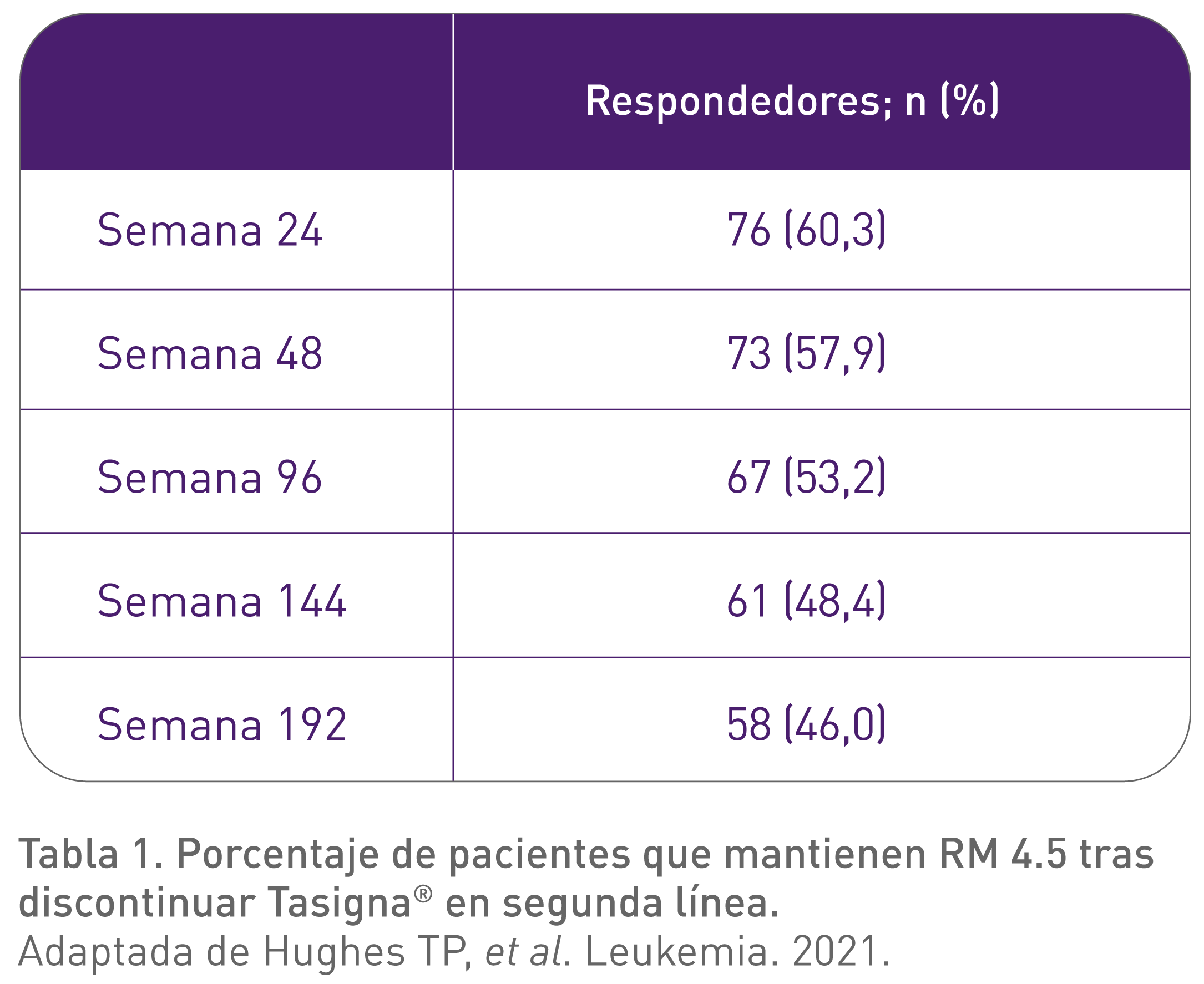
- El 60,3% (76/126) de los pacientes se mantuvieron en la fase de RLT con una RM 4.5 en la semana 24 después de la discontinuación.8-10
- El 57,9% (73/126) de los pacientes se mantuvieron en la fase de RLT con una RM 4.5 en la semana 48 después de la discontinuación.8
- Se observó durabilidad de la RLT a los 5 años de seguimiento, con una probabilidad de supervivencia libre de tratamiento (SLT) del 49,4% (IC 95%: 40,3 – 57,9).8
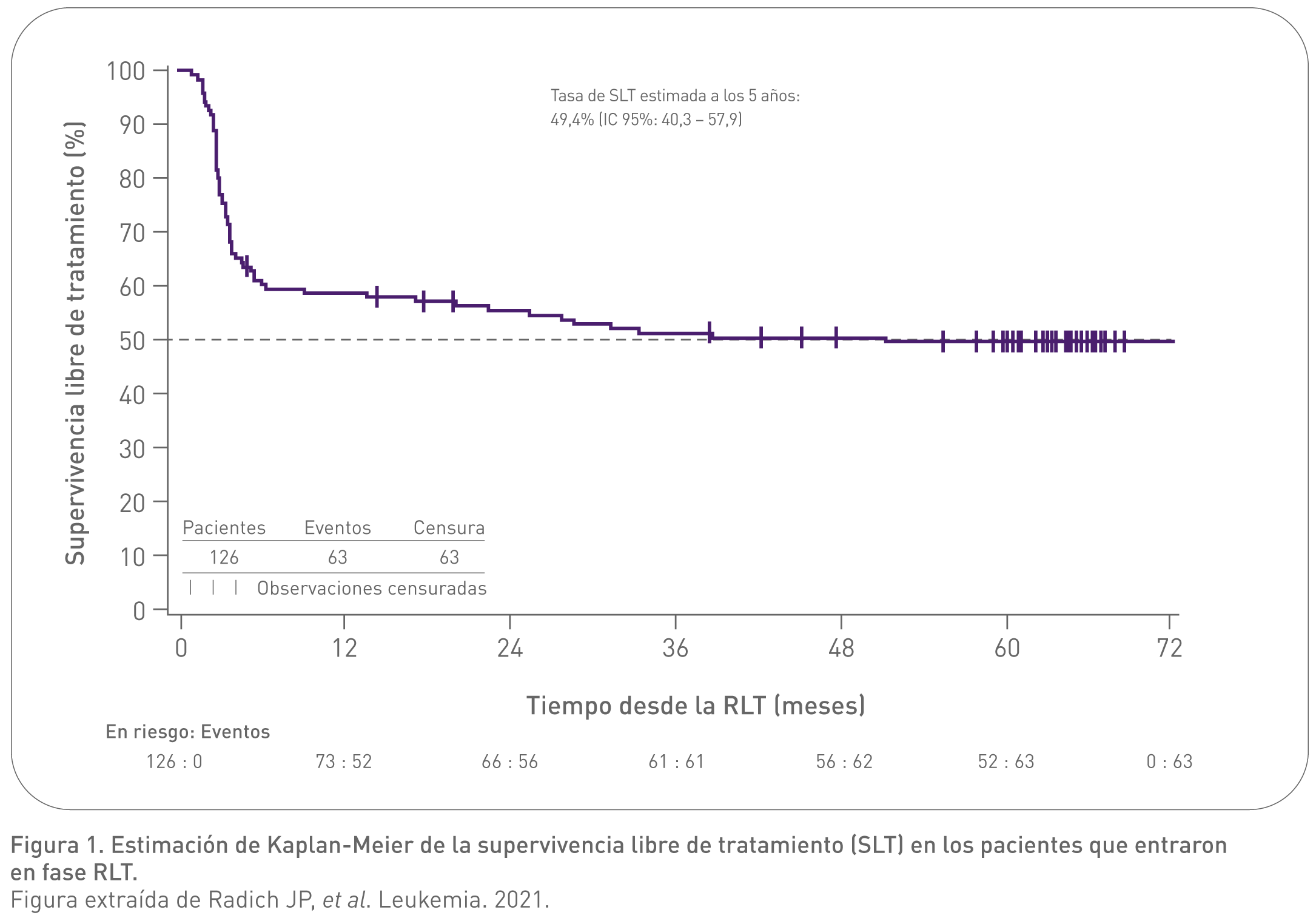
- Prácticamente todos los pacientes que reiniciaron Tasigna® alcanzaron RM4 o RM4.5, y la RM 4/4.5 alcanzada fue mantenida en la mayoría de los pacientes.8
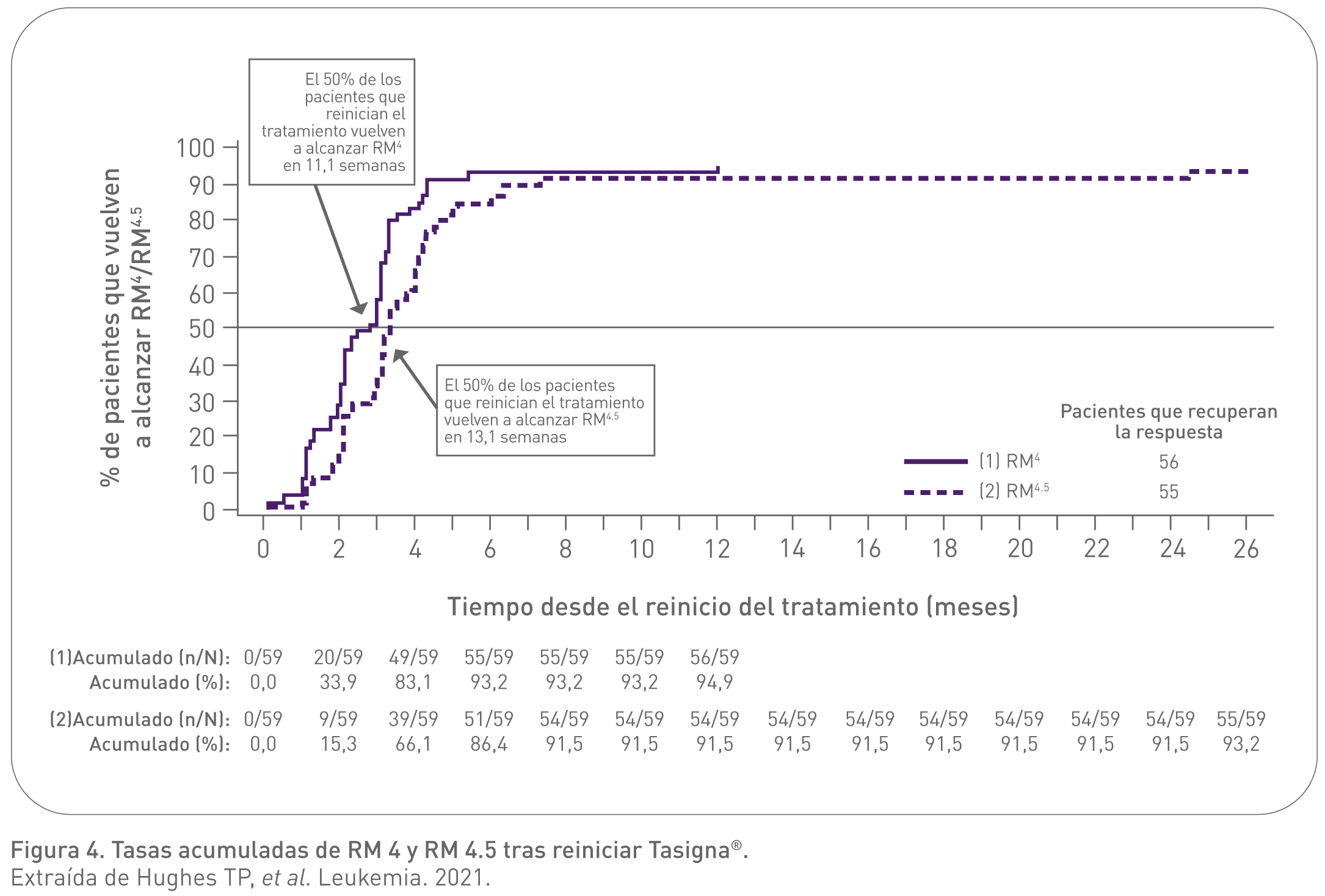
Los resultados del ENESTop demostraban que la RLT se mantiene en la mayoría de los pacientes que alcanzan una respuesta molecular profunda con Tasigna en segunda línea.
Además, no se observaron nuevos efectos adversos y su frecuencia disminuyó a lo largo de la RLT.8
Estudio Fase III prospectivo, aleatorizado, abierto, multicéntrico y de dos brazos de tratamiento.6 Se evaluó la RLT tras dos duraciones distintas de consolidación del tratamiento en segunda línea de Tasigna en pacientes con leucemia mieloide crónica tratados previamente con imatinib.6
El objetivo primario del estudio fue determinar el número de pacientes que continuaron en RLT (≥RM 4.0) sin recaída molecular* 12 meses después de la discontinuación tras 12 o 24 meses de mantenimiento de la respuesta molecular profunda (consolidación) con Tasigna.6
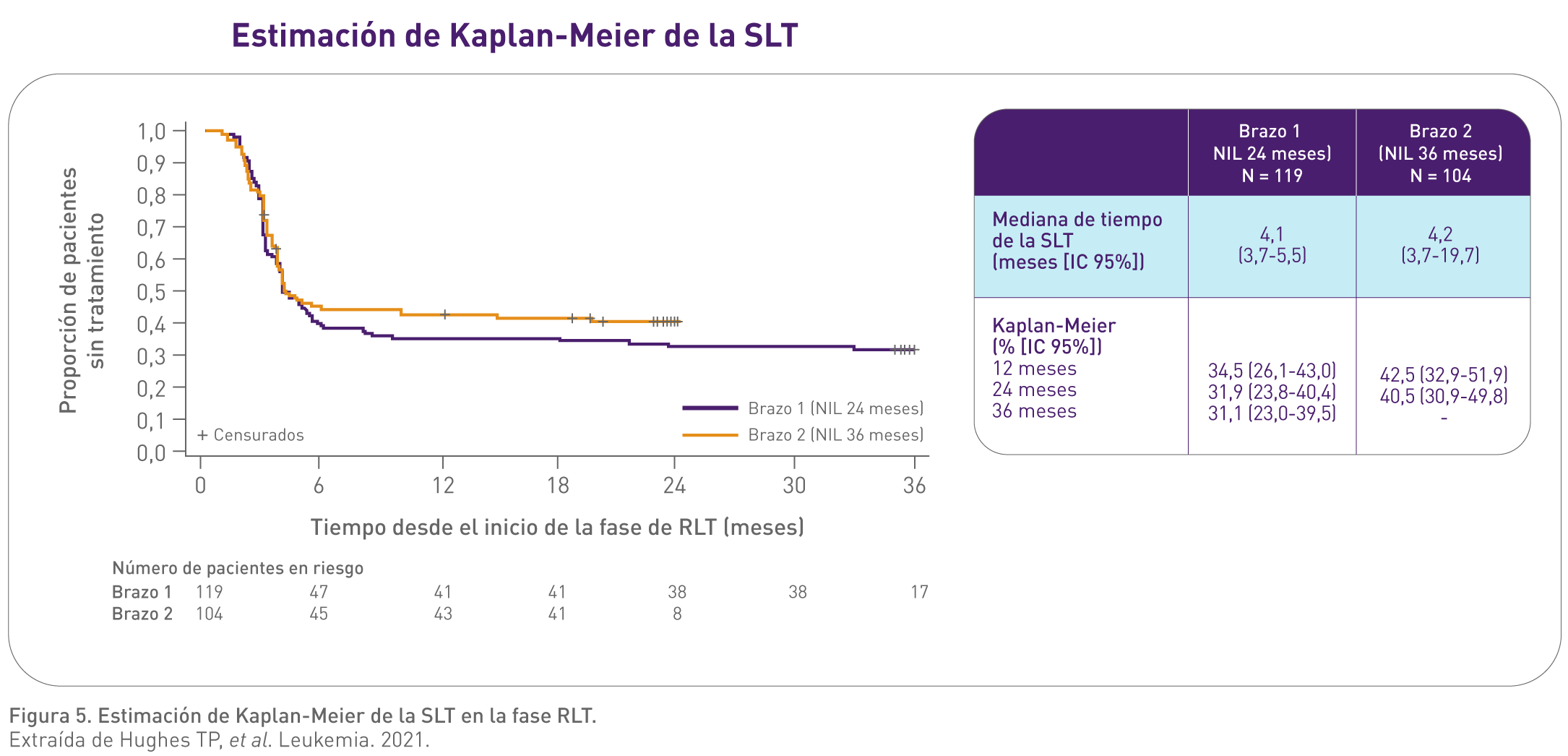
No se observaron diferencias significativas en la tasa de recaída molecular al final de los 12 meses de la fase de RLT entre el Grupo 1 (grupo de consolidación con Tasigna durante 24 meses) y el Grupo 2 (grupo de consolidación con Tasigna durante 36 meses).6
Estos resultados sugieren que no hay un beneficio adicional significativo en términos de éxito de la RLT de un año adicional de consolidación con Tasigna para los pacientes con LMC en fase crónica en tratamiento con Tasigna tras un cambio de imatinib.6
Independientemente de la duración de la consolidación, el cambio a Tasigna 300 mg BID ofreció la oportunidad de alcanzar la RLT a muchos pacientes que no lograron una respuesta molecular profunda mantenida con imatinib en primera línea.6
El perfil de seguridad se correspondió con los hallazgos anteriores, no hubo ningún caso de progresión (ni a fase acelerada ni a crisis blástica) y no se observaron señales de seguridad adicionales en el estudio.6
Puedes acceder al estudio haciendo clic aquí.
Con receta Médica. Diagnóstico Hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los Hospitales; por lo tanto irá desprovisto de cupón precinto. PVL TASIGNA 150 MG 112 CAPSULAS 2.706,17 €. PVL TASIGNA 200 MG 112 CAPSULAS 3.608,23 €. La indicación leucemia mieloide crónica pediátrica está pendiente de tramitación de precio y condiciones de financiación.
Referencias:
1. Sociedad Española de Hematología y Hemoterapia. Manual para el control y el tratamiento de los pacientes con Leucemia Mieloide Crónica. Edición 2020. Disponible en: https://www.sehh.es/publicaciones/manuales-publicaciones/124461-manual-p... 2. Mahon FX, Etienne G. Deep molecular response in chronic myeloid leukemia: the new goal of therapy?. Clin Cancer Res. 2014;20(2):310-322. 3. Breccia M, Alimena G. Discontinuation of tyrosine kinase inhibitors and new approaches to target leukemic stem cells: treatment-free remission as a new goal in chronic myeloid leukemia. Cancer Lett. 2014;347(1):22-28 4. Hochhaus A, Masszi T, Giles FJ, et al. Treatment-free remission following frontline Tasigna in patients with chronic myeloid leukemia in chronic disease: results from the ENESTfreedom study. Leukemia. 2017;31(7):1525-1531. 5. Mahon FX, Boquimpani C, Kim DW, et al. Treatment-Free Remission After Second-Line Tasigna Treatment in Patients With Chronic Myeloid Leukemia in Chronic Phase: Results From a Single-Group, Phase 2, Open-Label Study. Ann Intern Med. 2018;168(7):461-470. 6. Delphine R, et al. Treatment-Free Remission (TFR) after Two Different Durations of Tasigna Consolidation in Patients with Chronic Myeloid Leukemia (CML) Previously Treated with Imatinib: Enestpath Study Results. Blood. 2021;138:635.
7. Radich JP, Hochhaus A, Masszi T, et al. Treatment-free remission following frontline Tasigna in patients with chronic phase chronic myeloid leukemia: 5-year update of the ENESTfreedom trial. Leukemia. 2021;35(5):1344-1355. 8. Hughes TP, Clementino NCD, Fominykh M, et al. Long-term treatment-free remission in patients with chronic myeloid leukemia after second-line nilotinib: ENESTop 5-year update. Leukemia. 2021;35(6):1631-1642. 9. Hughes TP, Boquimpani C, Kim D, et al. Treatment-free remission (TFR) in patients (pts) with chronic myeloid leukemia in chronic phase (CML-CP) treated with second-line nilotinib (NIL): first results from the ENESTop study. J Clin Oncol 2016;(suppl):34. 10. Giles FJ, Masszi T, Gômez Casares MT, et al. Treatment-free remission (TFR) following frontline (1L) nilotinib (NIL) in patients (pts) with chronic myeloid leukemia in chronic phase (CML-CP): 192-week data from the ENESTfreedom study.J Clin Oncol.2019;(15 suppl):37.



