Desde su aprobación, Tasigna® ha acumulado múltiples publicaciones con evidencia en vida real que apoyan su uso tanto en primera como en segunda línea.1-4 Los estudios de Real World Evidence (RWE) complementan los ensayos clínicos al incluir pacientes de la práctica clínica habitual.5
A continuación se muestran los principales resultados de los estudios de RWE de Tasigna:
I) Evaluación de candidatos a remisión libre de tratamiento (RLT) en la LMC
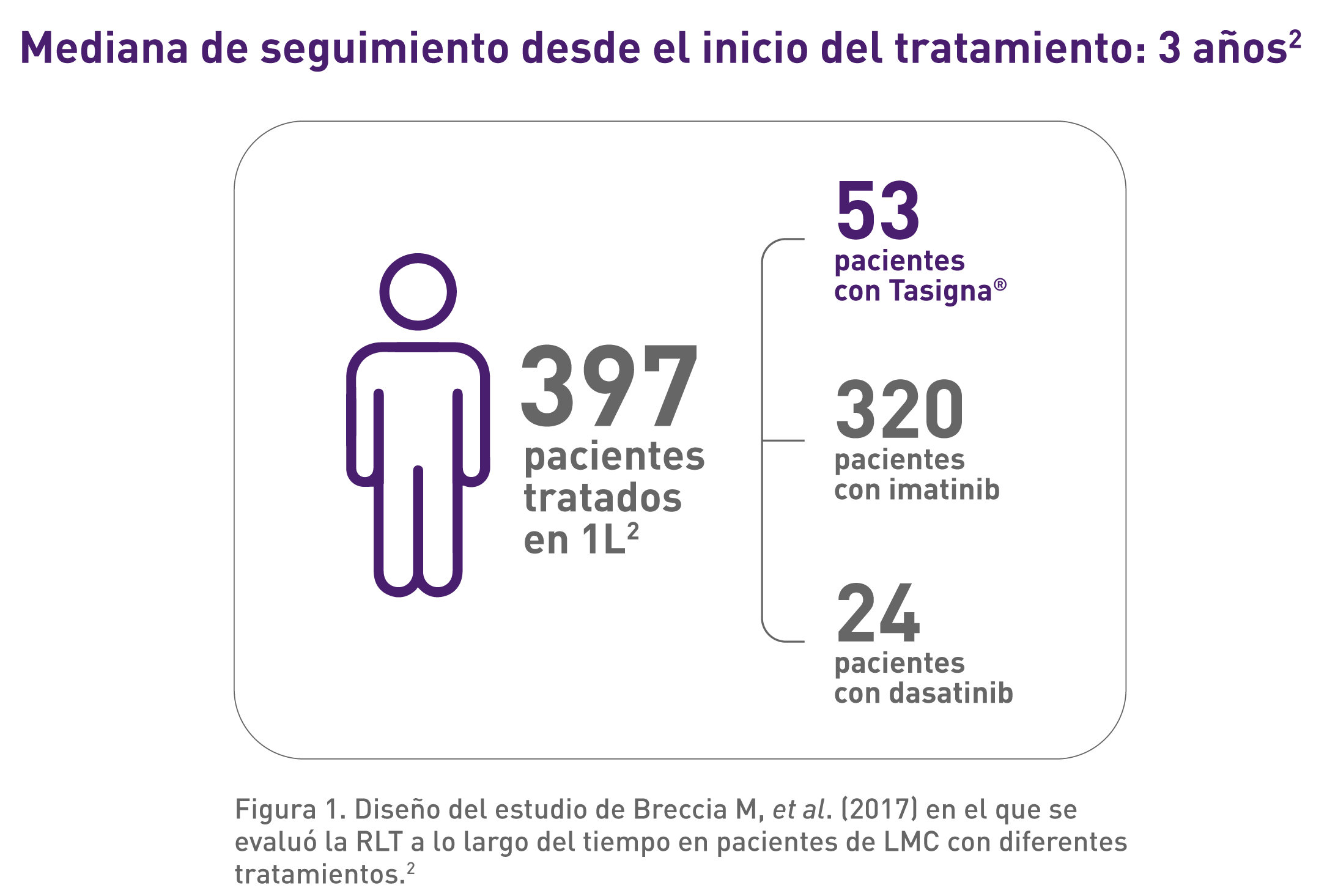
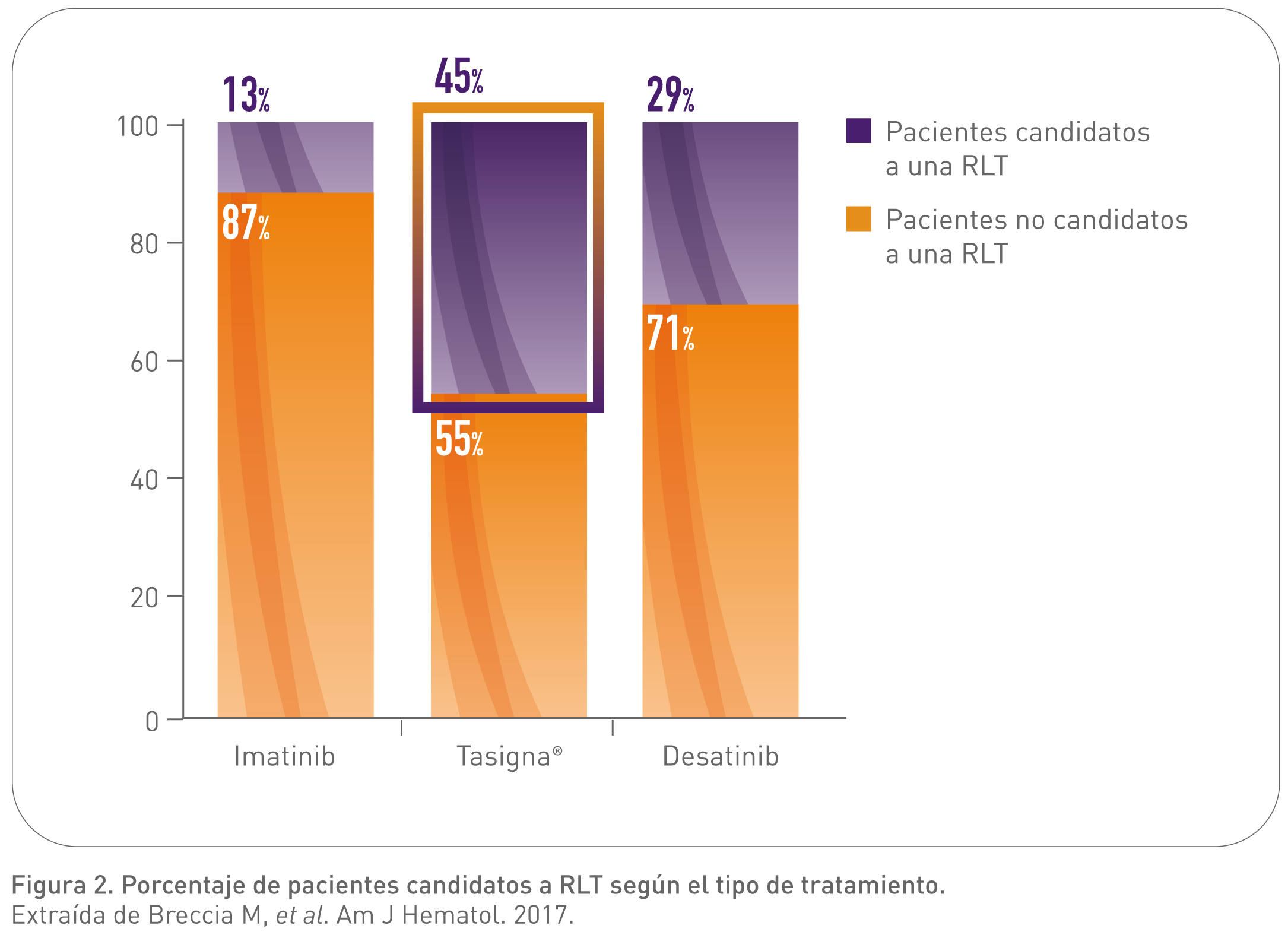
En este estudio de Breccia M, et al. (2017) se evidenció que con Tasigna el porcentaje de pacientes candidatos a remisión libre de tratamiento (RLT)* es superior a dasatinib y 3 veces superior a imatinib después de una mediana de seguimiento de 3 años.2
*Candidatos a RLT: respuesta molecular profunda (RM 4.5) durante más de un año (3 o 4 test moleculares consecutivos con el mismo nivel de respuesta).2
II) RLT con Tasigna frente a dasatinib en pacientes con LMC en fase crónica
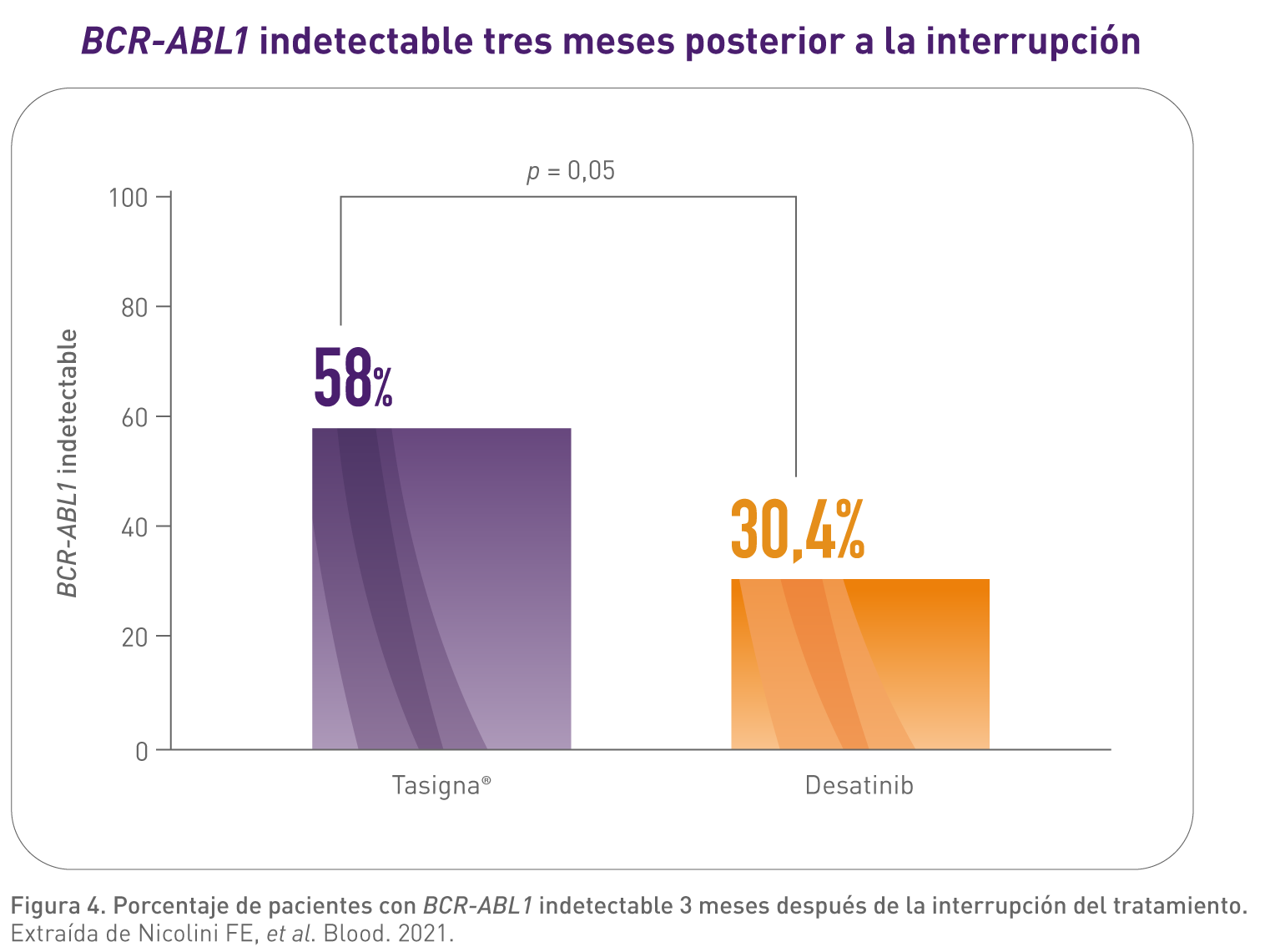
El estudio de Nicolini FE, et al. (2021) es un estudio observacional retrospectivo realizado en 3 centros franceses de referencia para LMC entre 2010 y 2021.3
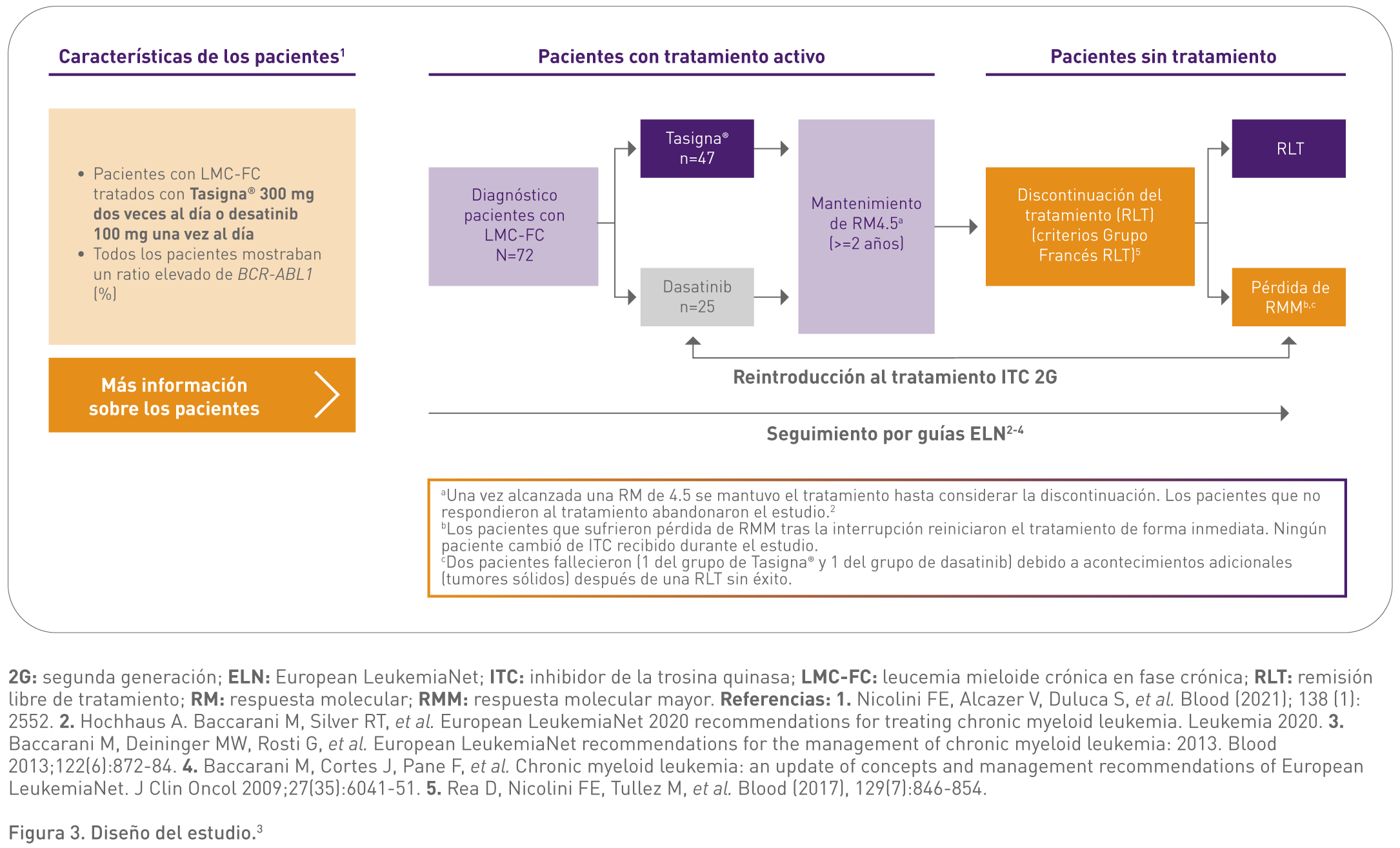
Se evidenció que con Tasigna se presentaron niveles de BCR-ABL1 indetectables tras la discontinuación en un porcentaje de pacientes mayor que con dasatinib.3
Con Tasigna la supervivencia sin pérdida de respuesta molecular mayor (RMM) tras la discontinuación fue significativamente mayor que con dasatinib.3
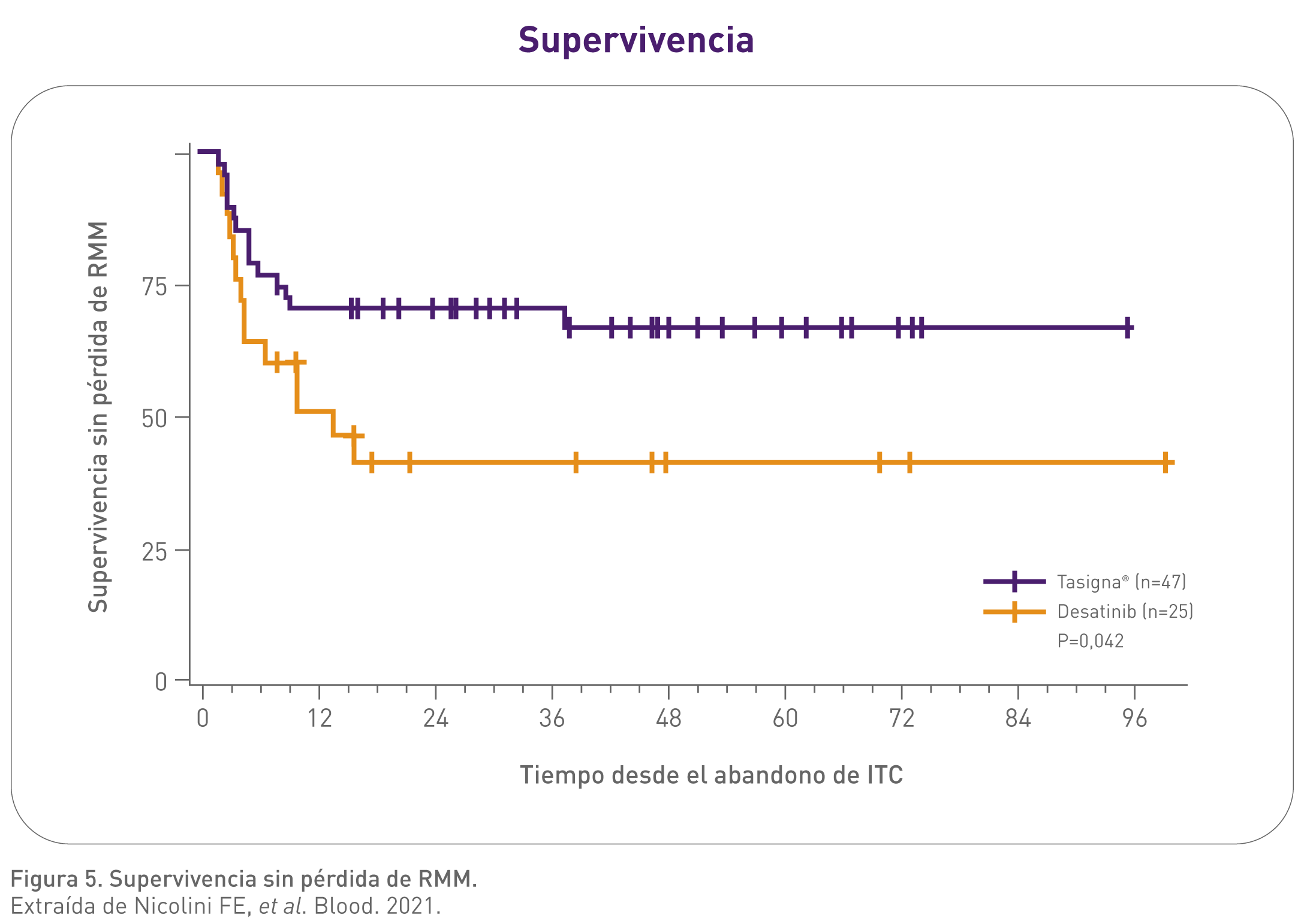
La mediana de la supervivencia sin pérdida de RMM no se alcanzó en el grupo de pacientes con Tasigna mientras que con el grupo de dasatinib se alcanzó a los 14 meses (p = 0,042).3
I) Tasigna frente a dasatinib en segunda línea4
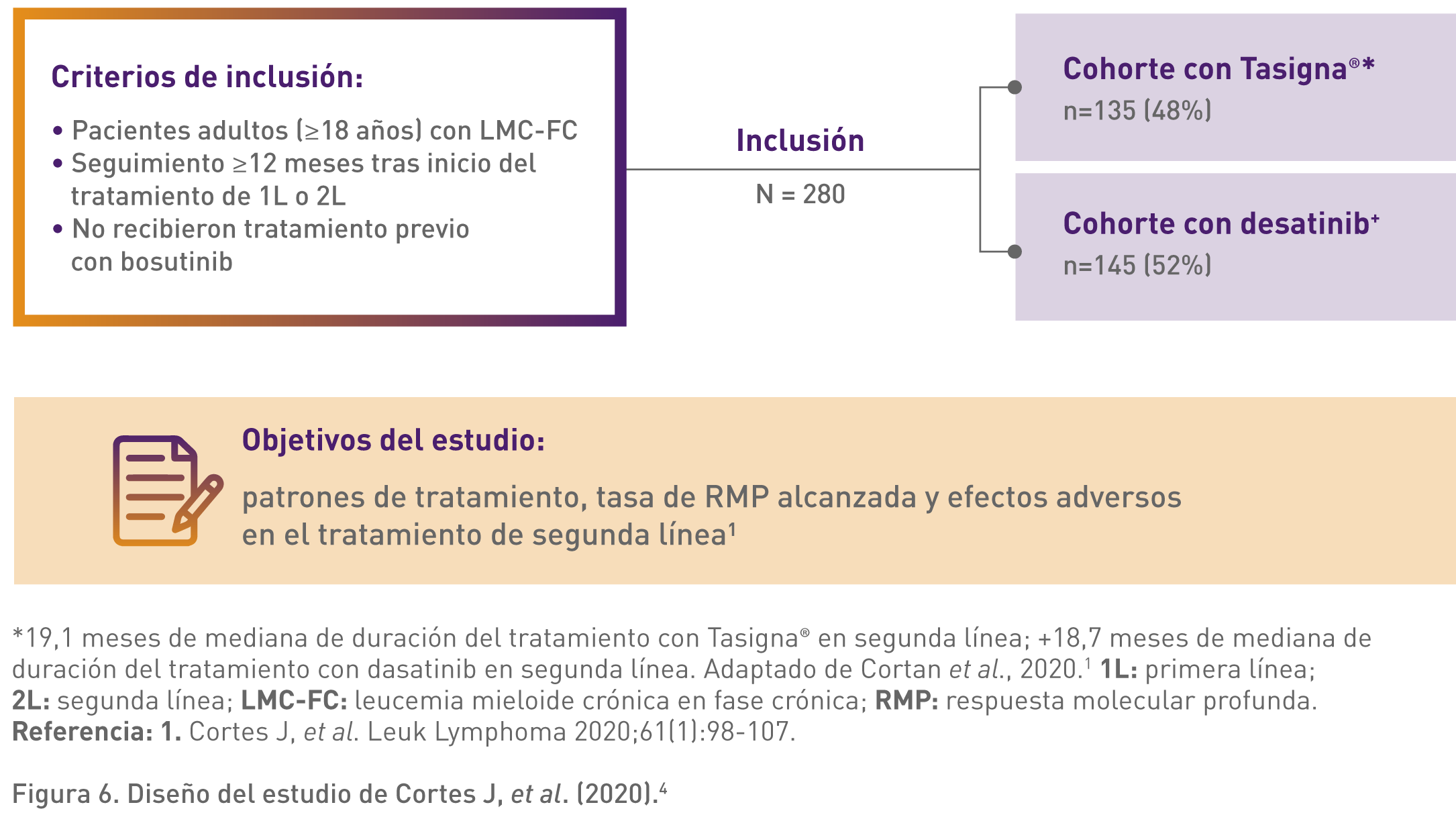
En el estudio retrospectivo de Cortes J, et al. (2020) se incluyeron pacientes con leucemia mieloide crónica en fase crónica tratados con Tasigna o dasatinib en segunda línea, para evaluar los patrones de tratamiento y la respuesta molecular profunda (RMP).4
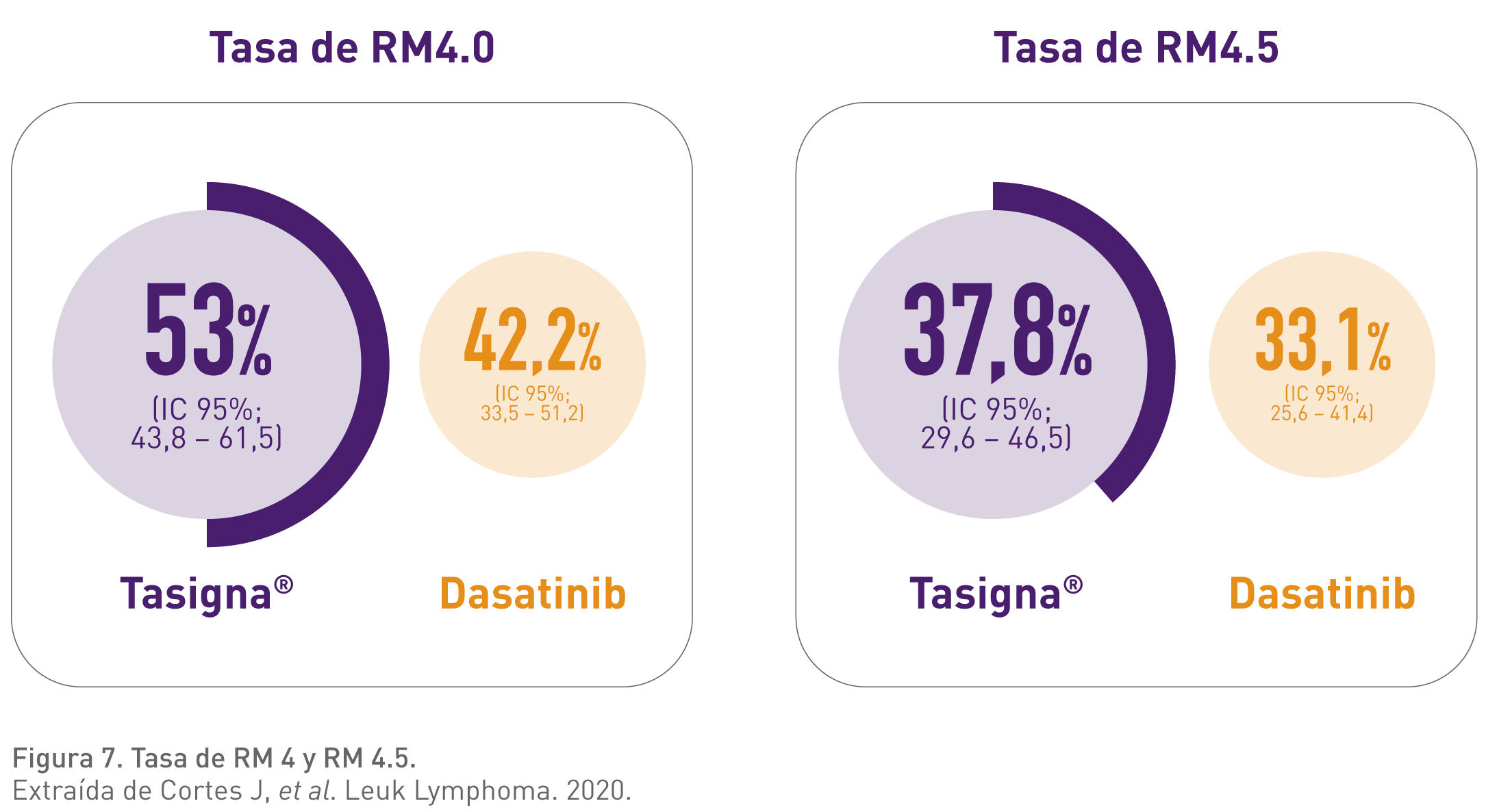
Con Tasigna alcanzaron respuesta molecular profunda (RM 4.0 y 4.5) un mayor porcentaje de pacientes que con dasatinib en segunda línea.4
Con receta Médica. Diagnóstico Hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los Hospitales; por lo tanto irá desprovisto de cupón precinto. PVL TASIGNA 150 MG 112 CAPSULAS 2.706,17 €. PVL TASIGNA 200 MG 112 CAPSULAS 3.608,23 €. La indicación leucemia mieloide crónica pediátrica está pendiente de tramitación de precio y condiciones de financiación.
Referencias:
1. Ficha Técnica de Tasigna. 2. Breccia M, Colafigli G, Molica M, et al. Timing and deepness of response to tyrosine kinase inhibitors as a measure of potential treatment discontinuation in chronic myeloid leukemia patients managed in the real-life. Am J Hematol. 2017;92(12):E668-E670. 3. Nicolini FE, Alcazer V, Dulucq S, et al. The Outcome of Treatment-Free Remission after First-Line Tasigna or Dasatinib in Chronic Phase Chronic Myeloid Leukemia Patients Is Different. Blood. 2021;138(S1):2552 4. Cortes J, Huynh L, Mendelson E, et al. Treatment patterns and deep molecular response in chronic phase - chronic myeloid leukemia patients treated with second-line Tasigna or dasatinib: a multi-country retrospective chart review study. Leuk Lymphoma. 2020;61(1):98-107. 5. Katkade VB, Sanders KN, Zou KH. Real world data: an opportunity to supplement existing evidence for the use of long-established medicines in health care decision making. J MultidiscipHealthc. 2018;11:295-304.