Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® tiene un perfil de seguridad demostrado
REVOLADE® es bien tolerado en pacientes con PTI, incluso en el tratamiento a largo plazo1-3
- El perfil de seguridad a más largo plazo estudiado en PTI (hasta 8,8 años): estudio EXTEND1.
- El estudio EXTEND demuestra que incluso utilizando REVOLADE® durante años, puede ser no solo consistente en eficacia, sino tolerable y seguro en la mayoría de los pacientes1.
- No se identificaron nuevas alertas de seguridad respecto a los acontecimientos adversos descritos en el estudio RAISE a 6 meses1.
- Según el estudio RAISE, la incidencia de efectos adversos fue similar en ambos grupos de tratamiento. Los efectos adversos registrados en ambos grupos fueron en su mayoría de grado 1 y 22.
EA registrados2
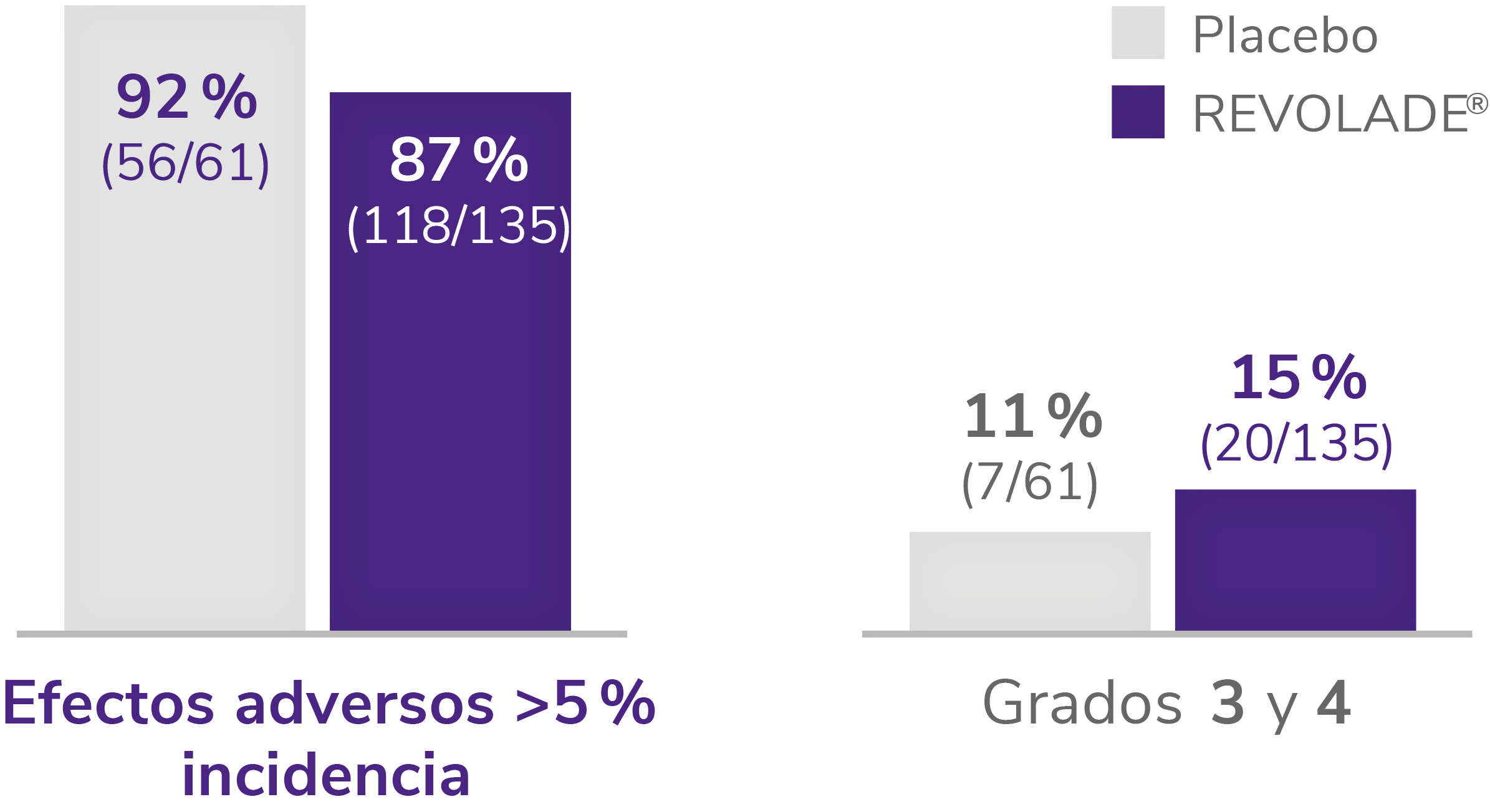
EA: efectos adversos. PTI: trombocitopenia inmune primaria
Efectos adversos durante el estudio EXTEND1
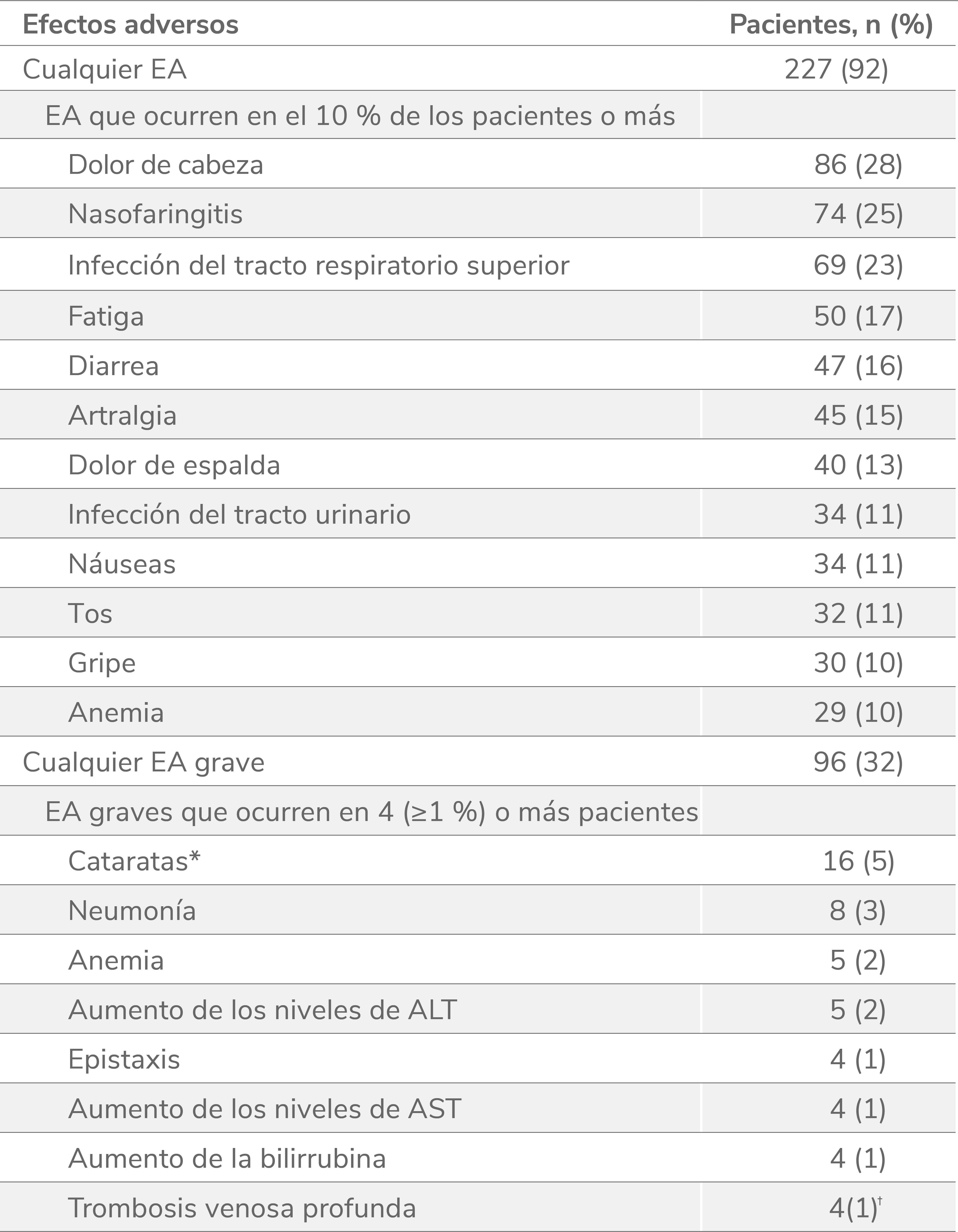
Efectos adversos durante la terapia (n = 302).
EA:efectos adversos; ALT: alanina aminotransferasa, AST: aspartato aminotransferasa.
*El protocolo del estudio requería que las cataratas fueran reportadas como EA grave.
†Las trombosis venosas profundas indicadas se categorizaron por el término principal. Un paciente tuvo 2 trombosis venosas profundas. Otro paciente se le clasificó como que había sufrido una trombosis y más tarde se consideró que sufrió una trombosis venosa profunda.
- 41 pacientes (14 %) abandonaron debido a efectos adversos en el estudio EXTEND a largo plazo1.
En pacientes pediátricos (≥ 1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® tiene un perfil de seguridad demostrado
Perfil de seguridad sólido en el estudio PETIT4
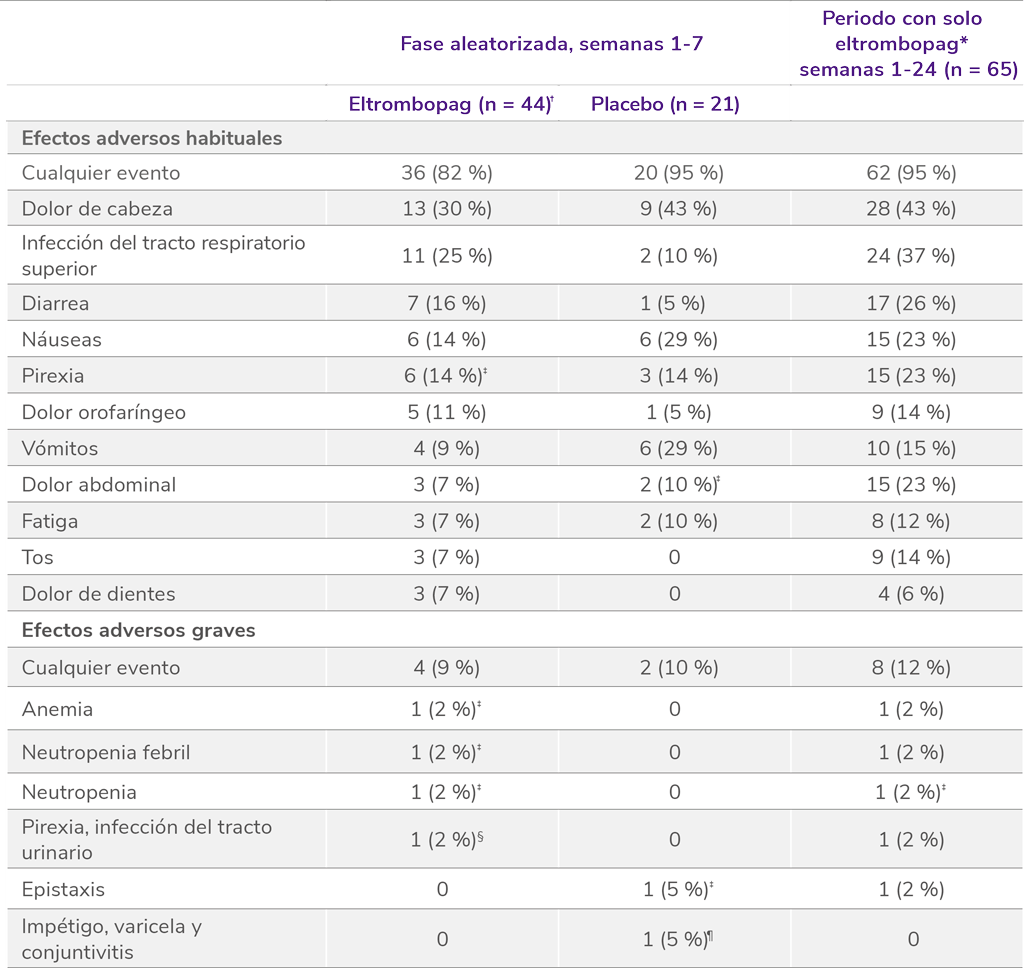
Los datos son n (%). Como efectos adversos se consideraron el número de eventos ocurridos en al menos el 5 % de los pacientes que recibieron eltrombopag durante el período de doble ciego. Los pacientes podían experimentar más de un efecto adverso.
*La población del periodo con solo eltrombopag incluye a todos los pacientes asignados a recibir eltrombopag que recibieron la medicación del estudio.
†La población de seguridad incluye a un paciente asignado a placebo que recibió eltrombopag.
‡Incluye un efecto adverso de grado 3-4.
§Ambos de grado 3.
¶Incluye impétigo y varicela de grado 3.
Perfil de seguridad sólido en la fase doble ciego aleatorizada del estudio PETIT25
Efectos adversos en la fase doble ciego aleatorizada5
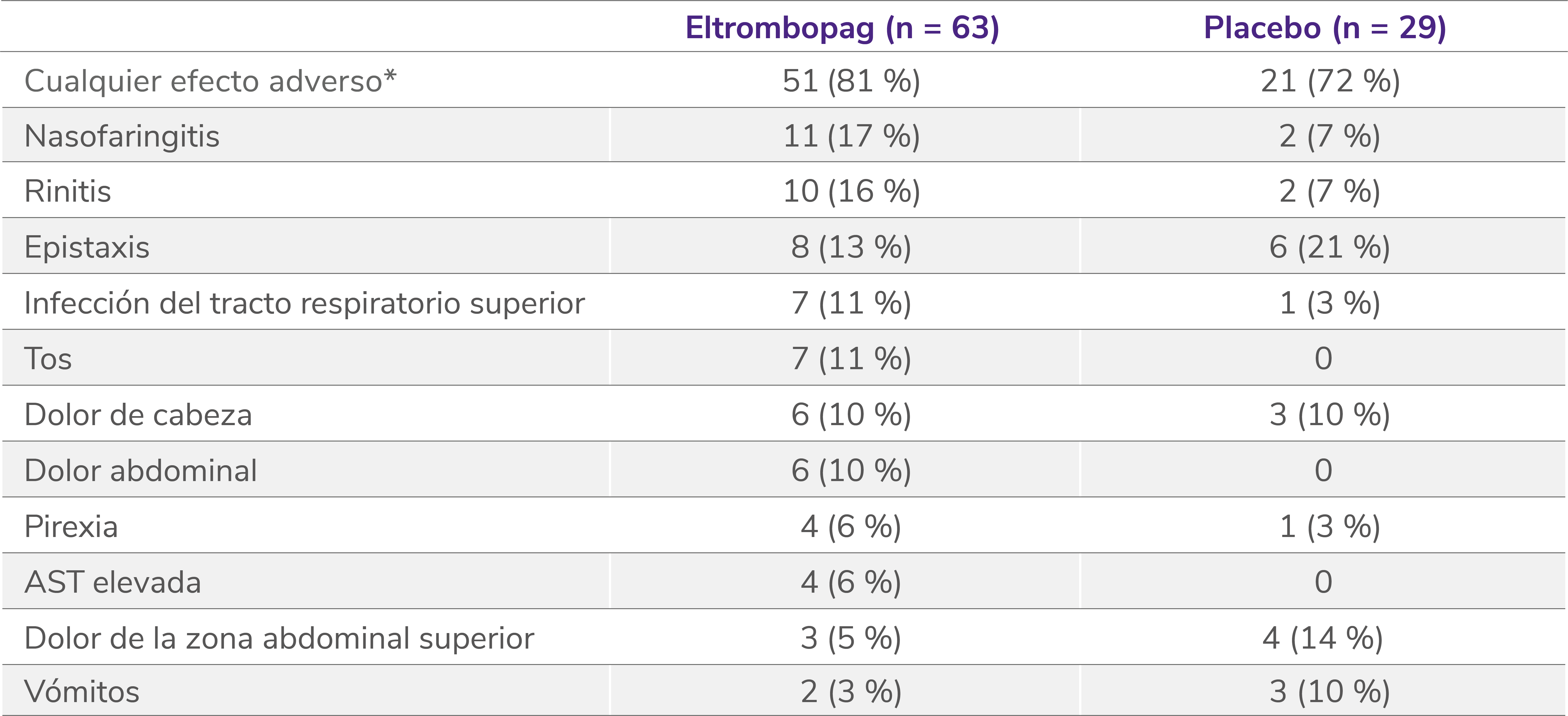
Los datos son n (%). Como efectos adversos se consideraron el número de eventos ocurridos en al menos el 5 % de los pacientes que recibieron eltrombopag durante el período de doble ciego. Los pacientes podían experimentar más de un efecto adverso.
AST: aspartato aminotransferasa.
*Efectos adversos ocurridos con cualquier frecuencia
Efectos adversos graves en la fase doble ciego aleatorizada5
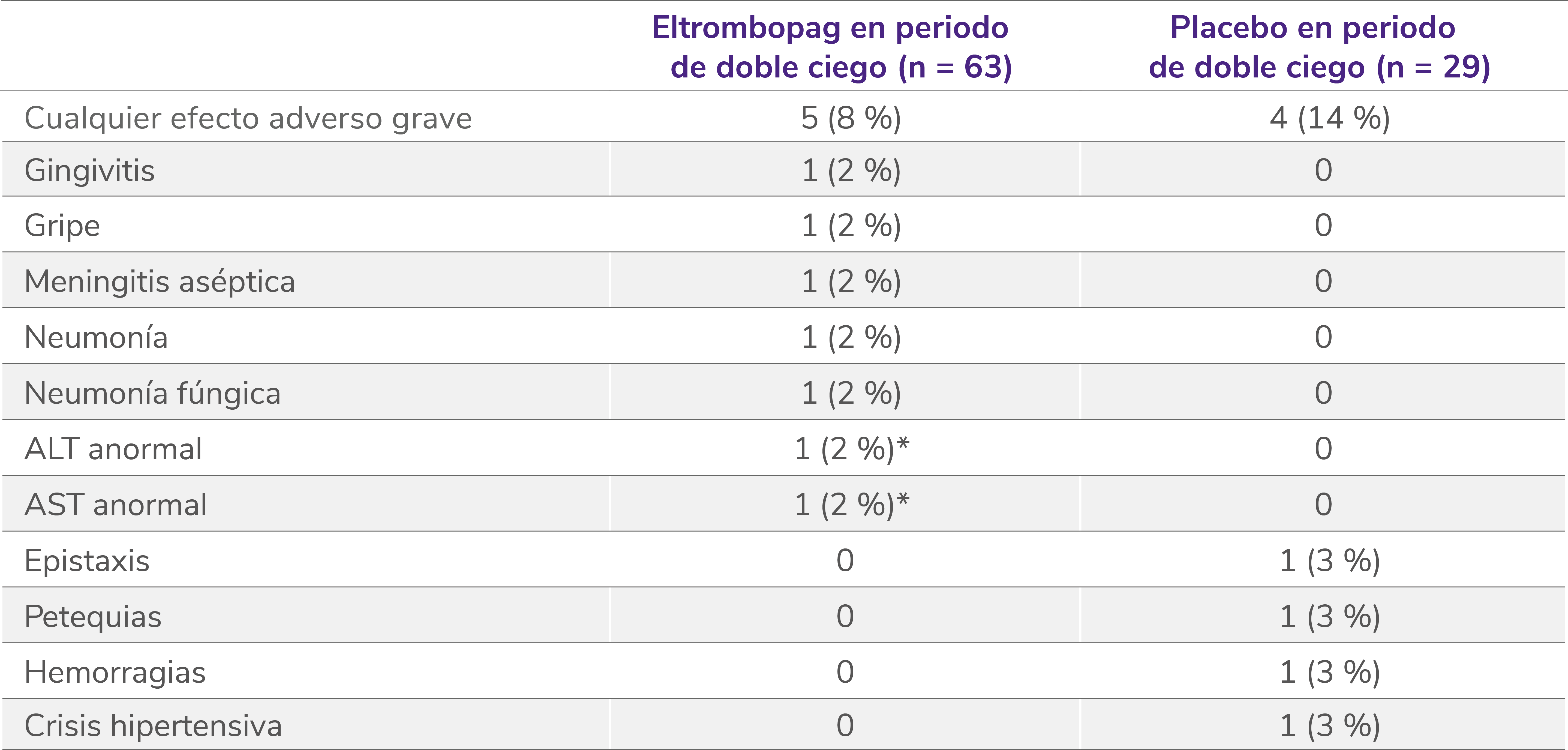
Los datos son n (%). Las frecuencias se basan en el número de pacientes que experimentan el evento. Los pacientes podían experimentar más de un efecto adverso.
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa.
*Considerado por el investigador como relacionado con el tratamiento.
PTI: trombocitopenia inmune primaria.
Referencias:
1. Wong RSM, et al.Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-36.
2. Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402.
3. Khelif A, et al. Changes in health-related quality of life with long-term eltrombopag treatment in adults with persistent/chronic immune thrombocytopenia: Findings from the EXTEND study. Am J Hematol. 2019;94:200-8.
4. Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015;2(8):e315-25.
5. Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-58.

