Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
REVOLADE® es único porque TÚ lo haces posible
1. Trombocitopenia inmune primaria en paciente adulto
Revolade está indicado en pacientes adultos para el tratamiento de la trombocitopenia inmune primaria (PTI) que son refractarios a otros tratamientos (por ejemplo, corticosteroides, inmunoglobulinas).
2. Trombocitopenia inmune primaria en paciente pediátrico
REVOLADE® está indicado en pacientes pediátricos de 1 año o más de edad para el tratamiento de la trombocitopenia inmune primaria (PTI) de 6 meses o más de duración desde el diagnóstico y que son refractarios a otros tratamientos (por ejemplo, corticosteroides, inmunoglobulinas).
3. Trombocitopenia asociada a la infección crónica por virus de la hepatitis C
REVOLADE® está indicado para el tratamiento de la trombocitopenia en pacientes adultos con infección crónica por el virus de la hepatitis C (VHC), cuando el grado de trombocitopenia es el principal factor que impide el inicio o limita la capacidad de mantener un tratamiento basado en interferón de forma óptima.
4. Aplasia medular grave (AMG)
REVOLADE® está indicado en pacientes adultos con AMG adquirida que han sido refractarios a un tratamiento inmunosupresor previo o muy pretratados y que no son candidatos a un trasplante de progenitores hematopoyéticos.
Trombocitopenia inmune primaria (PTI adultos y PTI pediatría)
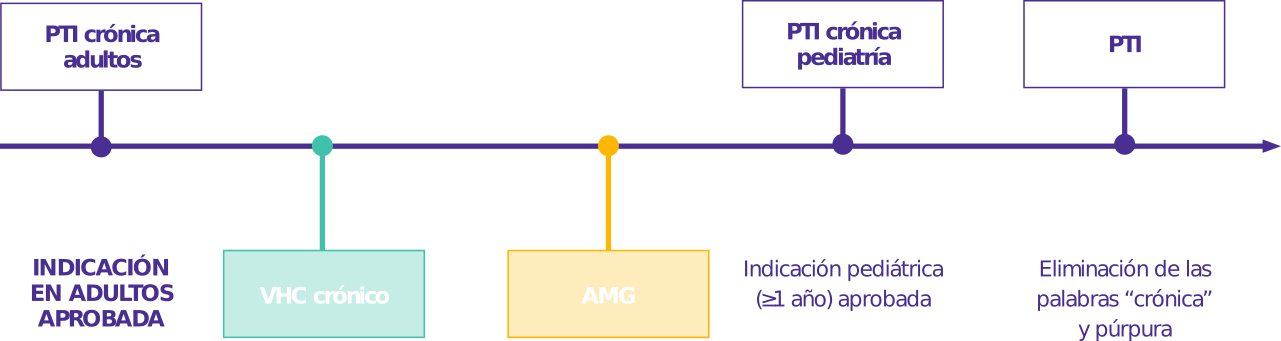
PTI: Trombocitopenia inmune primaria; HCV: virus de la hepatitis C; AAG: anemia aplásica grave. Las fechas de la primera aprobación global se muestran arriba.
Eltrombopag Global Data Sheet. Version 14. November 2016.
El primer AR-TPO aprobado para el tratamiento de niños de +1 año con PTI2,3
Para sus pacientes (≥ 1 año de edad) con PTI que son refractarios a un tratamiento previo REVOLADE® proporciona una respuesta rápida y sostenida2,3
- Rápida, respuestas visibles ya en la semana 14
En la semana 1, alcanzaron un número de plaquetas ≥50.000/μL

- Sostenida, respuestas mantenidas durante ≥6 semanas5
Para sus pacientes pediátricos (≥ 1 año de edad) con PTI que son refractarios a un tratamiento previo REVOLADE® proporciona una respuesta elevada1,4

De los pacientes con REVOLADE® alcanzaron una cifra de plaquetas ≥50.000/μL al menos una vez en ausencia de terapia de rescate1,4
Para sus pacientes pediátricos (≥ 1 año de edad) con PTI que son refractarios a un tratamiento previo REVOLADE® proporciona una reducción de las hemorragias y la medición concomitante1,4
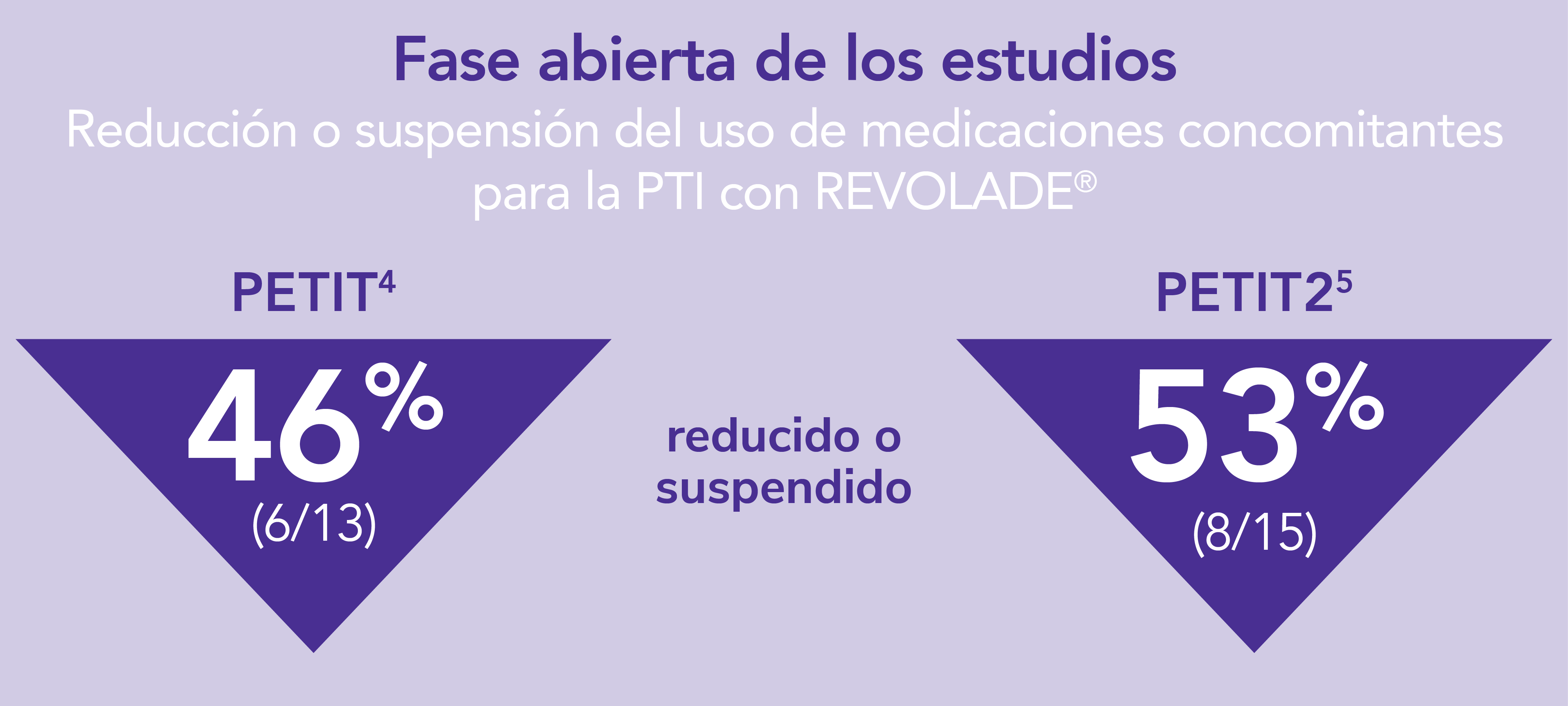
Para sus pacientes pediátricos (≥1 año de edad) con PTI que son refractarios a un tratamiento previo REVOLADE® tiene una buena tolerabilidad
Perfil de seguridad sólido en en el estudio PETIT4
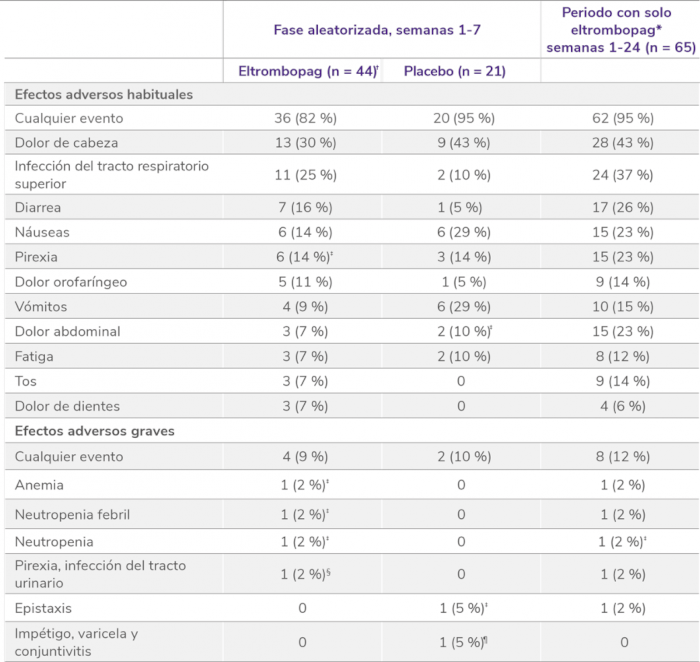
Los datos son n(%). Como efectos adversos se consideraron el número de eventos ocurridos en al menos el 5% de los pacientes que recibieron eltrombopag durante el período de doble ciego. Los pacientes podían experimentar más de un efecto adverso. *La población del periodo con solo eltrombopag incluye a todos los pacientes asignados a recibir eltrombopag que recibieron la medicación del estudio. † La población de seguridad incluye a un paciente asignado a placebo que recibió eltrombopag. ‡Incluye un efecto adverso de grado 3-4. § Ambos de grado 3. ¶Incluye impetigo y varicela de grado 3.
Perfil de seguridad sólido en la fase doble ciego aleatorizada del PETIT25
Efectos adversos en la fase doble ciego aleatorizada5
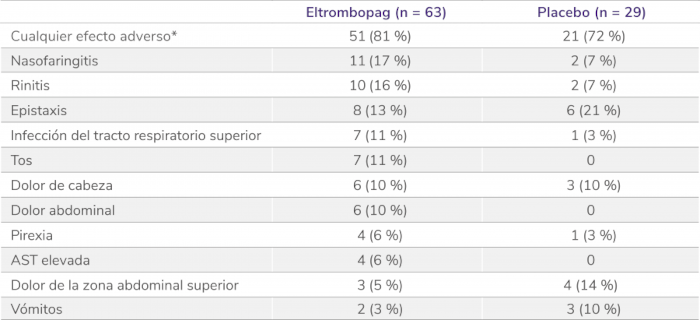
Los datos son n(%). Se han considerado efectos adversos ocurridos en ≥ 5% de los pacientes durante el periodo de doble ciego. Los pacientes podían experimentar más de un efecto adverso. AST: aspartato aminotransferasa. *Efectos adversos ocurridos con cualquier frecuencia.
Efectos adversos graves en la fase doble ciego aleatorizada5
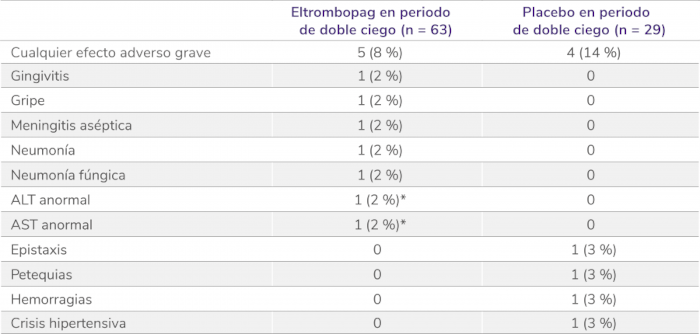
Los datos son n(%). Las frecuencias se basan en el número de pacientes que experimentan el evento. Los pacientes podían experimentar más de un efecto adverso, ALT: alanina aminotransferasa; AST: aspartato aminotransferasa. *Considerado por el investigador como relacionado con el tratamiento.
AR-TPO: agonista del receptor de la trombopoyetina.
Con un estudio de extensión de casi 9 años, evaluando la seguridad y eficacia a largo plazo en PTI adultos 6
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo REVOLADE® proporciona una respuesta elevada6

En pacientes adultos con trombocitopenia inmune primaria (PT) que son refractarios a un tratamiento previo REVOLADE® proporciona una respuesta rápida y sostenida6
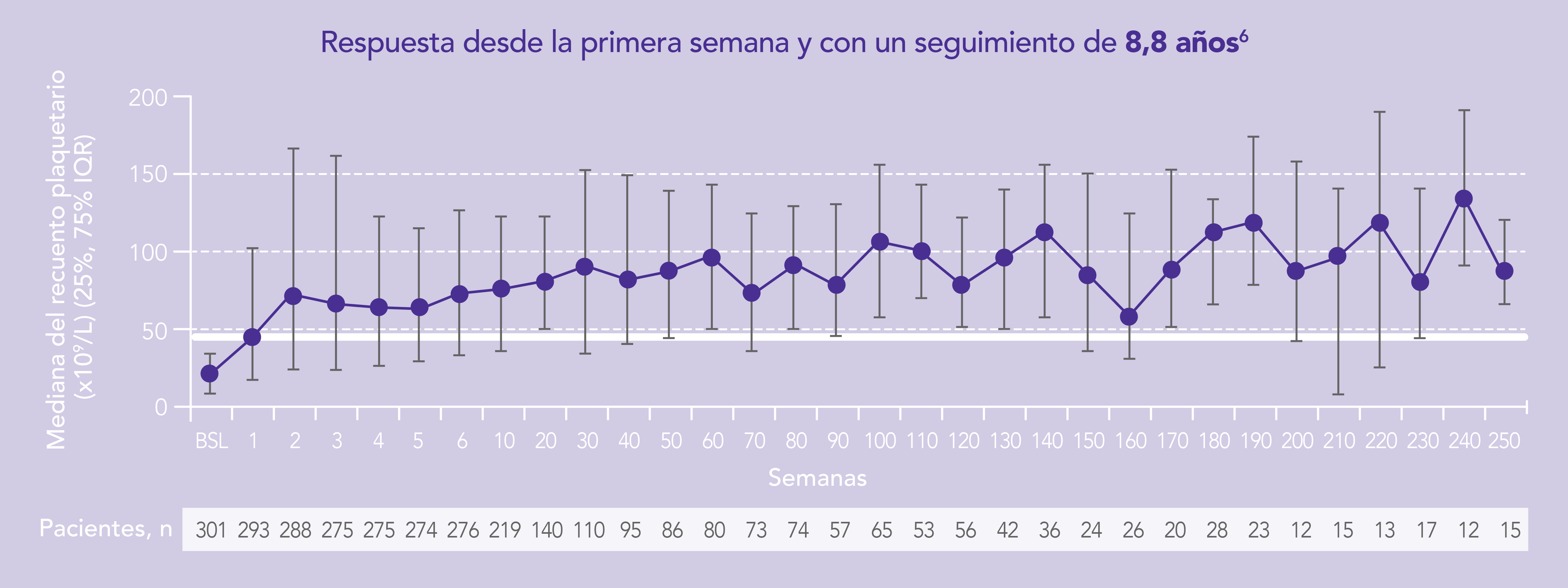
BSL: basal; IQR: rango intercuartílico
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante en el estudio EXTEND6
Incidencia de síntomas de hemorragia (OMS grados 1-4) en el estudio EXTEND a un año6

En el estudio a largo plazo EXTEND:

En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo REVOLADE® tiene el perfil de seguridad a más largo plazo demostrado
REVOLADE® es bien tolerado en pacientes con PTI, incluso en el tratamiento a largo plazo6.
- Perfil de seguridad a más largo plazo estudiado en PTI (hasta 8,8 años): estudio EXTEND6.
- El estudio EXTEND demuestra que incluso utilizando REVOLADE® durante años, puede ser no solo consistente en eficacia, sino tolerable y seguro en la mayoría de los pacientes6.
Con una evidencia científica demostrada por +700 publicaciones en PTI y AMG7
Publicaciones en revistas como:
- The Lancet Haematology
- Blood
- Lancet
- European journal of haematology
- Platelets
Con un gran número de ensayos clínicos en PTI adultos, PTI pediatría, AMG refractaria y Trombocitopenia asociada a la infección crónica por VHC1
PTI adultos
- TRA100773A8
Nº de pacientes con EPAG/total: 88/117
Estudio fase 2, aleatorizado, doble ciego, controlado con placebo, de 6 semanas de duración, para pacientes adultos con PTI ≥6 meses, ≥1 tratamiento previo y recuentos de plaquetas <30.000/μL.
Un número significativamente mayor de pacientes tomando REVOLADE® 50 mg o 75 mg alcanzaron ≥50.000/μL plaquetas comparado con placebo, la incidencia de hemorragias disminuyó, a estas dosis, según se incrementaba la cifra de plaquetas.
- TRA100773B9
Nº de pacientes con EPAG/total: 76/114
Estudio fase 3, aleatorizado, doble ciego, controlado con placebo, de 6 semanas de duración, para pacientes adultos con PTI ≥6 meses, ≥1 tratamiento previo y recuentos de plaquetas <30.000/μL.
Un número sustancialmente mayor de pacientes en el grupo de REVOLADE® alcanzó cifras de plaquetas ≥50.000/μL en el día 43 vs. placebo.
- RAISE10
Nº de pacientes con EPAG/total: 135/197
Estudio fase 3, aleatorizado, doble ciego, controlado con placebo, de 6 meses de duración, para pacientes adultos con PTI ≥6 meses, recuentos de plaquetas <30.000/μL, que habían respondido a ≥1 tratamiento previo para la PTI.
REVOLADE® mantuvo cifras de plaquetas entre 50.000-400.000/μL*, redujo el riesgo de hemorragias, mejoró de manera significativa la calidad de vida de los pacientes y un mayor número de pacientes redujo la medicación concomitante para la PTI en el brazo de REVOLADE® vs. placebo.
*Probabilidad de respuesta: 8,2 veces mayor con REVOLADE® vs. placebo; p <0,0001.
- REPEAT11
Nº de pacientes con EPAG/total: 66/66
Estudio fase 2, abierto, de un solo brazo, para la evaluación del uso intermitente de REVOLADE® para pacientes adultos con PTI ≥6 meses, recuentos de plaquetas entre 20.000-50.000/μL, que habían recibido al menos 1 tratamiento previo para la PTI.
REVOLADE® permitió alcanzar consistencia en la respuesta, definida como la proporción de pacientes con una respuesta en el ciclo 1 que también respondieron en el ciclo 2 o 3 sin aumentar la frecuencia y la gravedad de los EA en los ciclos sucesivos.
Un ciclo consistía en un periodo de 6 semanas en tratamiento seguido de 4 semanas sin tratamiento. Respuesta definida como ≥50.000/μL plaquetas, doblando el valor basal de ese ciclo tras hasta 42 días de tratamiento.
- EXTEND12
Nº de pacientes con EPAG/total: 302/302
Estudio de extensión, fase 3, abierto, de un solo brazo, para evaluar la seguridad, tolerabilidad y eficacia, con un seguimiento de 8,8 años, para pacientes adultos con PTI que hubieran completado un estudio previo con REVOLADE® .
El 86 % de los pacientes alcanzaron recuentos de plaquetas ≥50.000/μL y el 91 % ≥30.000/μL al menos una vez en ausencia de tratamiento de rescate. El 34 % de los pacientes discontinuó la medicación concomitante para la PTI y se redujeron las hemorragias en la mayoría de los pacientes.
La mediana del recuento de plaquetas se mantuvo (>50.000/μL) durante 250 semanas de tratamiento. El estudio EXTEND demuestra que REVOLADE®, aunque se use durante años, es eficaz, pero también tolerable y seguro en la mayoría de pacientes.
- BONE MARROW13
Nº de pacientes con EPAG/total: 167/167
Estudio fase 4, abierto, de seguridad de 2 años para evaluar los niveles de reticulina en MO y/o fibras de colágeno en basal y detectar si hay cualquier cambio tras 1 y 2 años de tratamiento con REVOLADE® en pacientes adultos con PTI persistente o crónica.
En basal, el 94 % de los pacientes tenían fibrosis en MO de grado 0 y el 6% de grado 1 según la escala 0-3 del Consenso Europeo. A los 2 años de tratamiento, el 89 % de los pacientes tenía grado 0, el 11% tenía grado 1, y ningún paciente tenía grado 2 o 3.
PTI pediatría
- PETIT4
Nº de pacientes con EPAG/total: 45/67
Estudio fase 2 de 3 partes, de cohorte escalonada, abierto y doble ciego, aleatorizado, y controlado con placebo. Incluyó a 67 niños ≥1 año con PTI ≥6 meses, en recaída o refractaria, con recuentos de plaquetas <30.000/μL y ≥1 tratamiento previo.
En la fase doble ciego aleatorizada y estratificada por edad, REVOLADE® permitió alcanzar recuentos de plaquetas ≥50.000/μL al menos una vez en ausencia de tratamiento de rescate durante ≥6 semanas desde la semana 5 a la 12 del periodo de doble ciego en el 40% de los pacientes vs. el 3% con placebo. Las respuestas con REVOLADE® fueron similares en todos los grupos de edad.
En la fase abierta del estudio, REVOLADE® permitió alcanzar recuentos de plaquetas ≥50.000/μL al menos una vez en ausencia de tratamiento de rescate en el 80% de los pacientes.
La respuesta clínica se mostró por la reducción en la gravedad de las hemorragias de 71% en basal a 24% en la semana 24. La mayoría de los pacientes tomando medicación concomitante para la PTI discontinuó estos tratamientos. REVOLADE® fue bien tolerado.
AMG
- AMG14,15
Nº de pacientes con EPAG/total: 43/43
Estudio fase 2, pivotal, no aleatorizado, iniciado por investigador, para evaluar la seguridad y respuesta hematológica en pacientes con AMG refractaria y describir la duración y calidad de las respuestas, el impacto de la discontinuación en respondedores robustos y la incidencia de evolución clonal. Incluyó a 43 pacientes ≥12 años con AMG refractaria después de al menos un tratamiento inmunosupresor previo y con un recuento de plaquetas ≤30.000/μL.
El 40% (17/43) de los pacientes alcanzaron la respuesta hematológica en ≥1 línea tras 12-16 semanas de tratamiento con REVOLADE®, 7 pacientes lograron una respuesta trilínea y en 5 de ellos hubo una disminución gradual y discontinuación del fármaco manteniendo la respuesta, con una mediana de seguimiento de 13 meses sin el fármaco. 8 (19%) pacientes desarrollaron una nueva anomalía citogenética.
Trombocitopenia asociada a la infección crónica por VHC*
- ENABLE116
Nº de pacientes con EPAG/total: 715/715 Fase inicial - 450/682 Fase antiviral
Estudios fase 3 para pacientes con VHC y trombocitopenia (<75000/ul) de dos partes, fase inicial abierta de eltrombopag durante 9 semanas o menos y fase de tratamiento antiviral, aleatorizado, doble ciego, controlados con placebo (24 o 48 semanas según el genotipo de VHC).
Durante la fase inicial el 97% y el 96% de los pacientes del ENABLE-1 y ENABLE-2 respectivamente alcanzaron las cifras de plaquetas requeridos para iniciar el tratamiento antiviral.
Durante la fase de tratamiento antiviral, comparado con placebo una proporción significativamente mayor de pacientes con eltrombopag alcanzaron respuesta viral sostenida (objetivo primario del estudio) (ENABLE-1, 23% vs 14%, P = .0064; ENABLE-2, 19% vs 13%, P= .0202).
Los AA fueron similares entre ambos grupos, con la excepción de la descompensación hepática (en ambos estudios: eltrombopag 10%, placebo 5%) y los eventos tromboembólicos que fueron más comunes en el grupo de eltrombopag en el ENABLE-2.
- ENABLE216
Nº de pacientes con EPAG/total: 805/805 Fase inicial - 506/759 Fase antiviral
Estudios fase 3 para pacientes con VHC y trombocitopenia (<75000/ul) de dos partes, fase inicial abierta de eltrombopag durante 9 semanas o menos y fase de tratamiento antiviral, aleatorizado, doble ciego, controlados con placebo (24 o 48 semanas según el genotipo de VHC).
Durante la fase inicial el 97% y el 96% de los pacientes del ENABLE-1 y ENABLE-2 respectivamente alcanzaron las cifras de plaquetas requeridos para iniciar el tratamiento antiviral.
Durante la fase de tratamiento antiviral, comparado con placebo una proporción significativamente mayor de pacientes con eltrombopag alcanzaron respuesta viral sostenida (objetivo primario del estudio) (ENABLE-1, 23% vs 14%, P = .0064; ENABLE-2, 19% vs 13%, P= .0202).
Los AA fueron similares entre ambos grupos, con la excepción de la descompensación hepática (en ambos estudios: eltrombopag 10%, placebo 5%) y los eventos tromboembólicos que fueron más comunes en el grupo de eltrombopag en el ENABLE-2.
Con un gran número de pacientes reclutados en sus ensayos pivotales1

*en pacientes que van a recibir un tratamiento basado en interferón1
Con significación estadística demostrada en la disminución del riesgo de hemorragias y de la necesidad de medicación concomitante en PTI adultos y PTI pediatría en sus ensayos pivotales4,5,10
En sus pacientes adultos con PTI que son refractarios a un tratamiento previo REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante (estudio RAISE10)
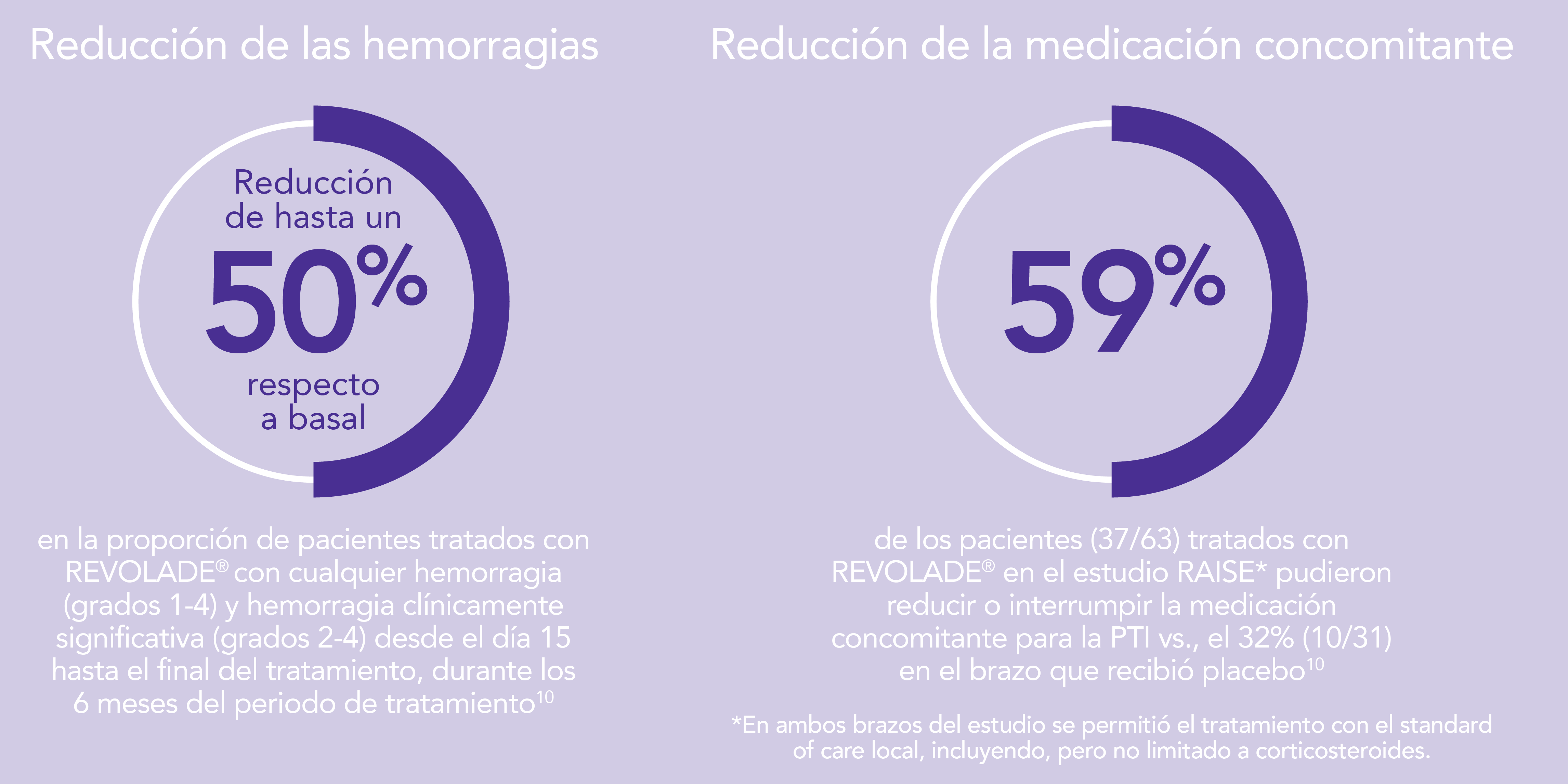
REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante en niños con PTI4,5
- Reducción de hemorragias:

El único AR-TPO disponible en comprimidos y polvo para suspensión oral1
REVOLADE® disponible en 2 formas farmacéuticas
Proporciona la posibilidad de discontinuar el tratamiento manteniendo la respuesta en AMG refractaria15
REVOLADE® restaura la hematopoyesis trilinear en AMG refractaria que puede mantenerse tras la discontinuación del fármaco15
- En pacientes con aplasia medular grave refractaria REVOLADE® proporcionó una respuesta multilínea.
- En el estudio de Fase II para evaluar la seguridad y respuesta hematológica de pacientes con AMG refractaria se observó:

Referencias:
1. Bao W, et al.Ficha técnica de REVOLADE®.
2. Desmond R, et al.GEPAR REVOLADE®: https://www.ema.europa.eu/en/documents/variation-report/revolade-h-c-111....
3. Liu X, et al. EPAR NPLATE®: https://www.ema.europa.eu/en/documents/variation-report/nplate-h-c-942-i....
4. Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015; 2(8): e315-e325.
5.Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015; 386 (10004): 1649-1658.
6. Wong RSM, et al. Safety and effcacy of long term treatment of chronic/persistent ITP with eltrombopag :final results of the EXTEND study. Blood . 2017;130(23):2527 2536. Blood. 2018;131(6):709.
7. Resultados en PubMed. Último acceso: septiembre 2023. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/?term=eltrombopag+AND+((immune+thrombocytopenia)+OR+(severe+aplastic+anemia))
8. Resultados en PubMed. Último acceso: septiembre 2023. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/?term=eltrombopag+AND+((immune+thrombocytopenia)+OR+(severe+aplastic+anemia))
9. Bussel JB, et al. Effect of eltrombopag on platelet counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomised, double-blind, placebo-controlled trial. Lancet. 2009 Feb 21;373(9664):641-8.
10. Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6 month, randomised , phase 3 study. Lancet. 2011;377(9763):393 402.
11. Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6 month, randomised , phase 3 study. Lancet. 2011;377(9763):393 402.
12. Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536. Brynes RK, et al. Acta Haematol. 2017;137:66-72.
13. Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536. Brynes RK, et al. Acta Haematol. 2017;137:66-72.
14. Olnes MJ, et al. Eltrombopag and improved hematopoiesis in refractory aplastic anemia. N Engl J Med. 2012 Jul 5;367(1):11-9
15. Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
16. Afdhal NH, et al. Eltrombopag increases platelet numbers in thrombocytopenic patients with HCV infection and cirrhosis, allowing for effective antiviral therapy. Gastroenterology. 2014;146(2):442-452.e1.

