Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una respuesta rápida, sostenida, elevada y significativa1,2
Rápida y sostenida1
Respuesta desde la primera semana y con un seguimiento de 8,8 años1
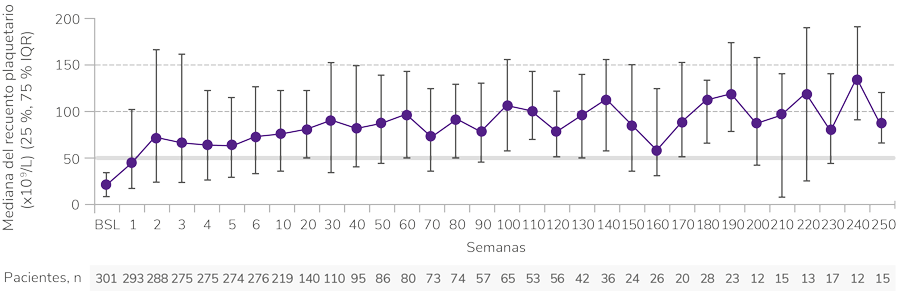
BSL: basal; IQR: rango intercuartílico.
Elevada1

Significativa1
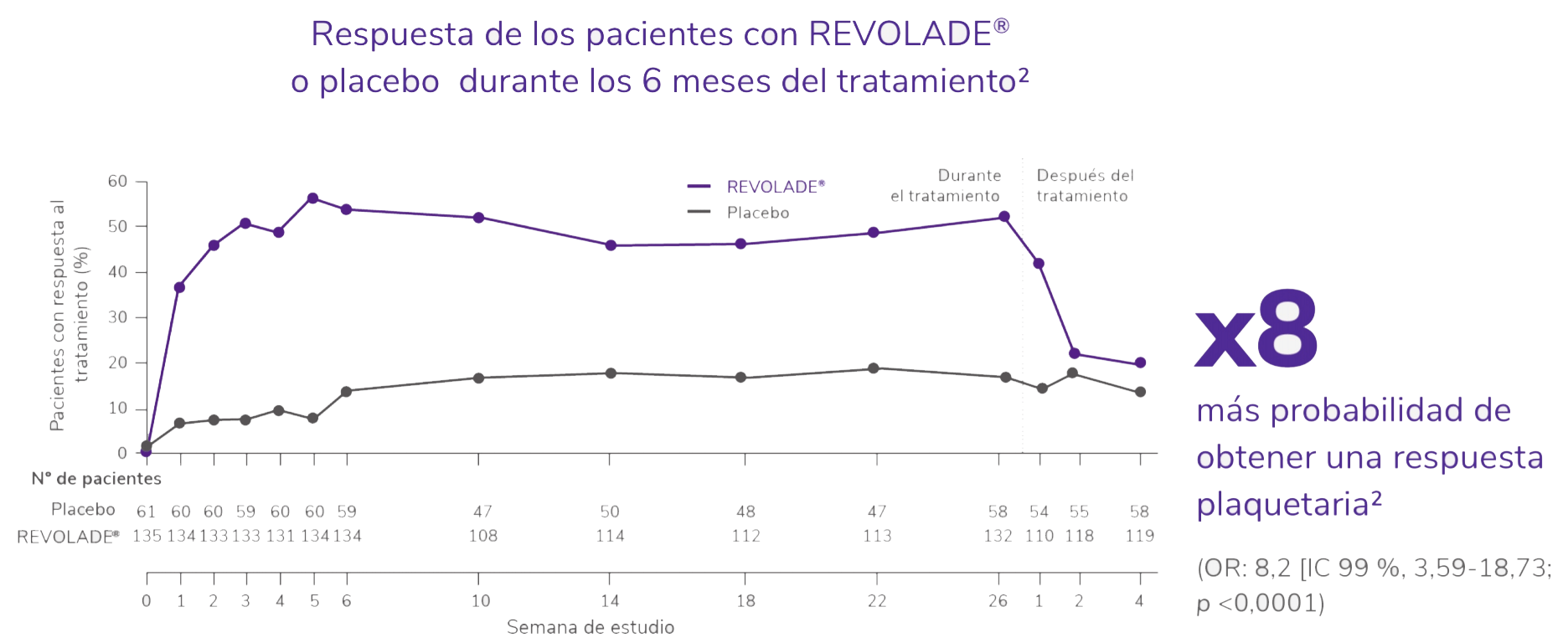
IC: Intervalo de Confianza; OR: odds ratio.
REVOLADE® reduce las hemorragias en pacientes con PTI que son refractarios a un tratamiento previo1,2
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una reducción de las hemorragias1,2
Reducción de las hemorragias en el estudio RAISE2
|
|
En la proporción de pacientes tratados con REVOLADE® cualquier hemorragia (grados 1-4) y hemorragia clínicamente significativa (grados 2-4) desde el día 15 hasta el final del tratamiento, durante los 6 meses del periodo de tratamiento2 |
Reducción de las hemorragias en el estudio EXTEND1
Incidencia de síntomas de hemorragia (OMS grados 1-4) en el estudio EXTEND a un año1

REVOLADE® permite a los pacientes con PTI reducir el uso de medicación concomitante1,2
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® reduce la necesidad de medicación concomitante1,2
Reducción del uso de medicación concomitante

REVOLADE® ha demostrado también mejorar la calidad de vida relacionada con la salud2,3
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® protege y mejora de manera significativa la calidad de vida de los pacientes2,3
Resultados del estudio RAISE2
REVOLADE® mejora significativamente las puntuaciones en algunos dominios de los cuestionarios de calidad de vida SF-36v2 y FACT-Th6 a la semana 262
Cambios medios respecto al basal en las escalas SF-36v2 y FACT-Th6 (RAISE)2
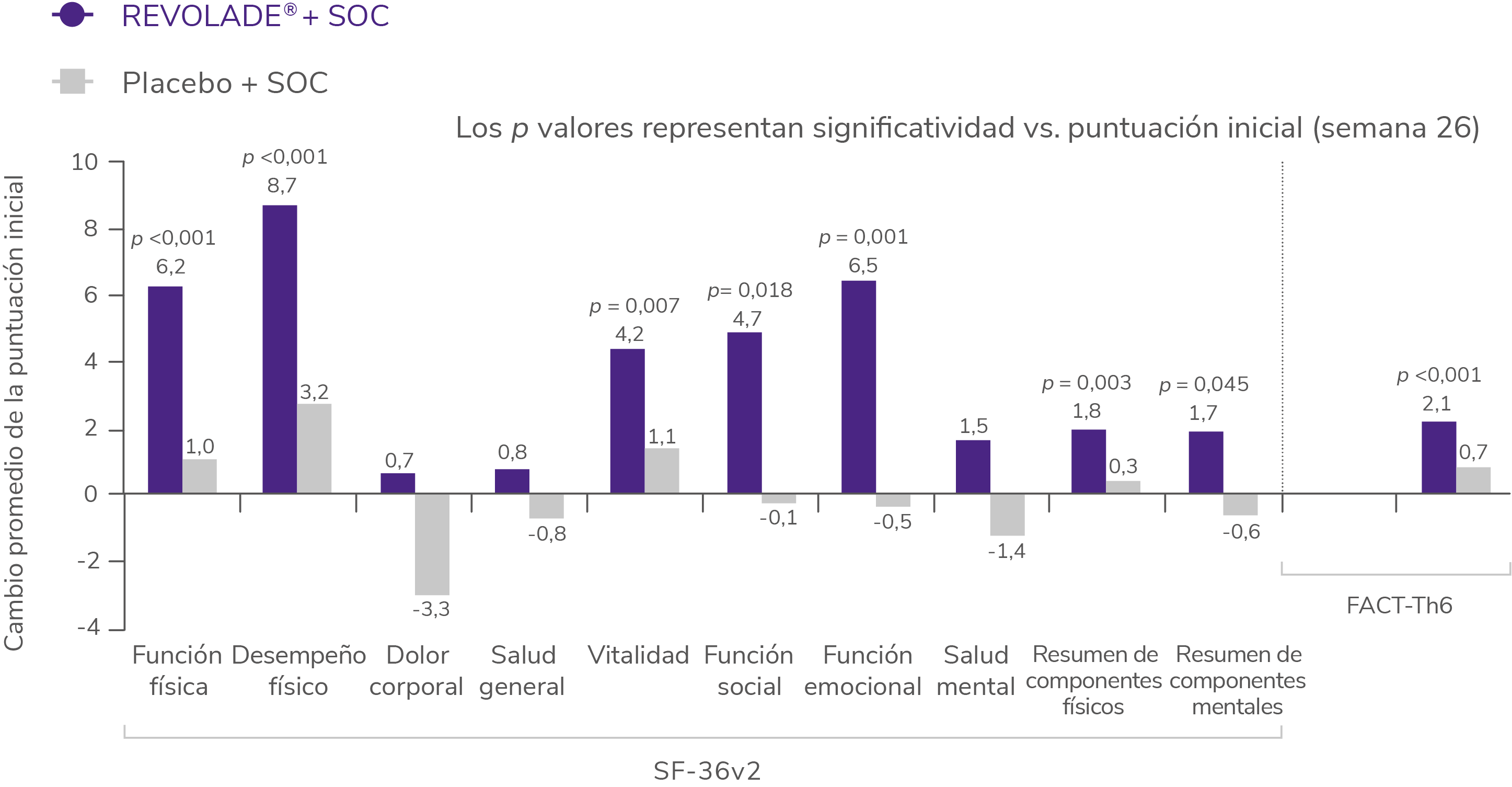
La calidad de vida relacionada con la salud se midió según la versión de memoria aguda del formulario abreviado 36 (Short Form-36), versión 2 (SF-36v2). El efecto de las hemorragias en la calidad de vida se evaluó con un subconjunto de 6 ítems del cuestionario Functional Assessment of Cancer Therapy-thrombocytopenia, (FACT-Th6, evaluación funcional del tratamiento del cáncer-trombocitopenia).
Tal y como se muestra en la figura, los pacientes que recibieron REVOLADE® reportaron mejoras significativas respecto al basal en 5 de 8 dominios del Short Form-36, versión 2 (SF-36v2) que determinan la calidad de vida2.
Adicionalmente, se observaron cambios significativos en:
- El resumen de los componentes físicos y mentales2.
- La puntuación del subgrupo de ítems del cuestionario Functional Assessment of Cancer Therapy-thrombocytopenia (FACT-Th6) utilizado para evaluar el impacto de la hemorragia y los hematomas en la calidad de vida de los pacientes2.
Sobre el SF-36v22
La versión de memoria aguda del cuestionario SF-36v2 se utilizó para medir la calidad de vida relacionada con la salud expresada en la puntuación de 8 dominios de puntuaciones y 2 resúmenes de componentes

Resultados del estudio EXTEND
REVOLADE® proporciona mejoras en las puntuaciones desde el basal en las medidas relacionadas con3:

Las mejoras en la calidad de vida observadas con REVOLADE® se asociaron significativamente con3:

REVOLADE® proporciona una respuesta rápida y sostenida en pacientes pediátricos (≥1 año) con PTI que son refractarios a un tratamiento previo4-6
En pacientes pediátricos (≥1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una respuesta rápida y sostenida
Rápida, respuestas visibles ya en la semana 15
Estudio PETIT5
Fase doble ciego, aleatorizada y estratificada por la edad*5.
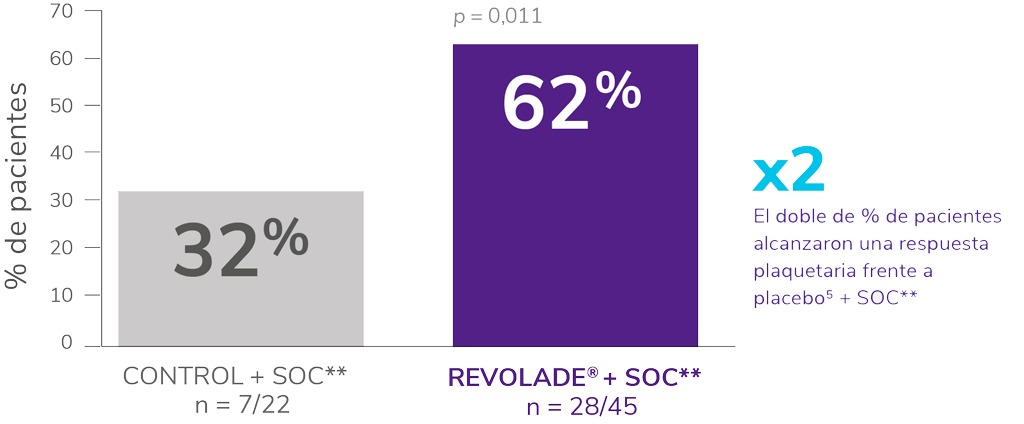
SOC: standard of care. *Endpoint primario: proporción de pacientes que alcanzan un recuento plaquetario de ≥ 50.000μL en ausencia de terapia de rescate durante ≥6 semanas desde la semana 5 a la 12 del periodo de doble ciego. **SOC: incluyó corticosteroides, IgV, anti-D. vincristina o vinblastina.
- Al inicio del estudio, ~51 % de los pacientes tenían un número de plaquetas ≤15.000/μL.
- En la semana 1, el 24 % de los pacientes alcanzaron un número de plaquetas ≥50.000/μL vs. el 14 % con placebo.
- Las tasas de respuesta con REVOLADE® fueron consistentes entre todos los grupos de edad
Fase abierta del estudio

Sostenida, respuestas mantenidas durante ≥6 semanas6
Estudio PETIT26
Fase doble ciego, aleatorizada y estratificada por la edad*6.
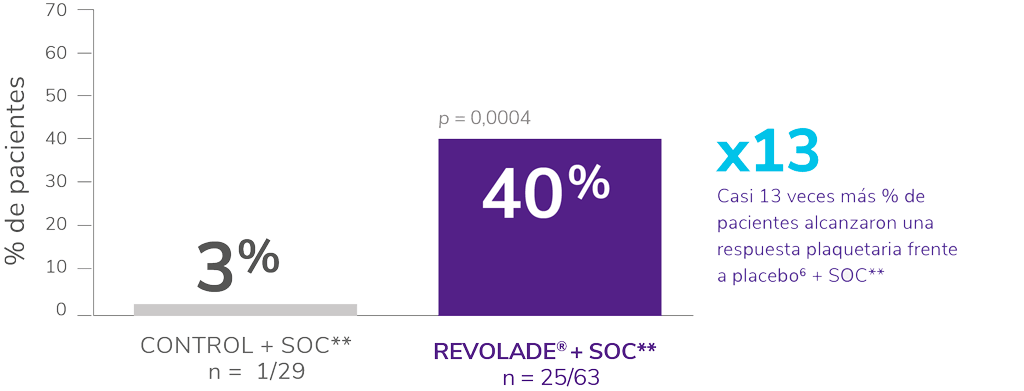
SOC: standard of care. *Endpoint primario: proporción de pacientes que alcanzan un recuento plaquetario de ≥ 50.000μL en ausencia de terapia de rescate durante ≥6 semanas desde la semana 5 a la 12 del periodo de doble ciego. **SOC: incluyó corticosteroides, IgV, anti-D. vincristina o vinblastina.
- Al inicio del estudio, ~62 % de los pacientes tenían un número de plaquetas ≤15.000/μL.
- Las tasas de respuesta con REVOLADE® fueron consistentes entre todos los grupos de edad.
Fase abierta del estudio

REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante en niños con PTI5,6
En pacientes pediátricos (≥1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una reducción de las hemorragias
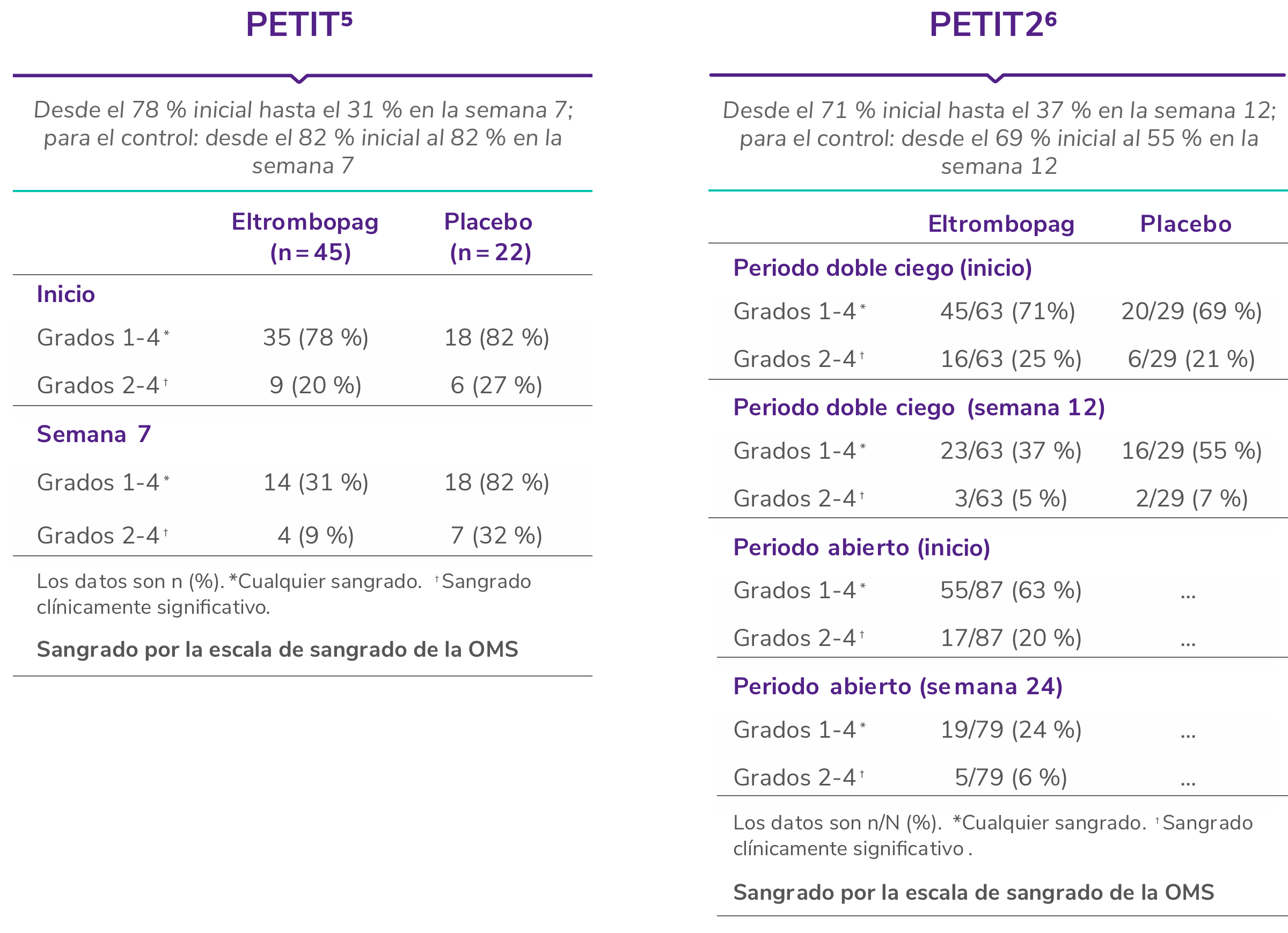
OMS: : Organización Mundial de la Salud; PTI: trombocitopenia inmune primaria.
En pacientes pediátricos (≥1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una reducción de la medicación concomitante
Fase abierta de los estudios
Reducción o suspensión del uso de medicaciones concomitantes para la PTI con REVOLADE®
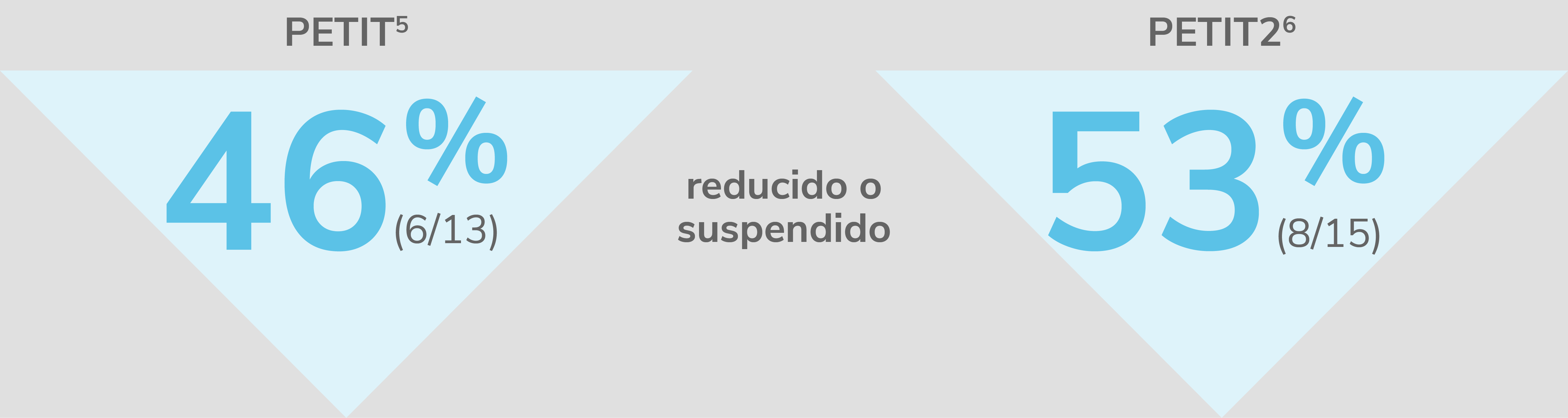
En pacientes adultos con PTI que son refractarios a un tratamiento previo
Estudios de REVOLADE® en trombocitopenia inmune primaria (PTI)
EXTEND1
Estudio de extensión abierto para evaluar la seguridad y eficacia a largo plazo de REVOLADE®
- Incluyó a 302 adultos con PTI que habían completado un estudio anterior de REVOLADE®
- Los datos son de hasta 8,8 años de tratamiento continuo con REVOLADE®
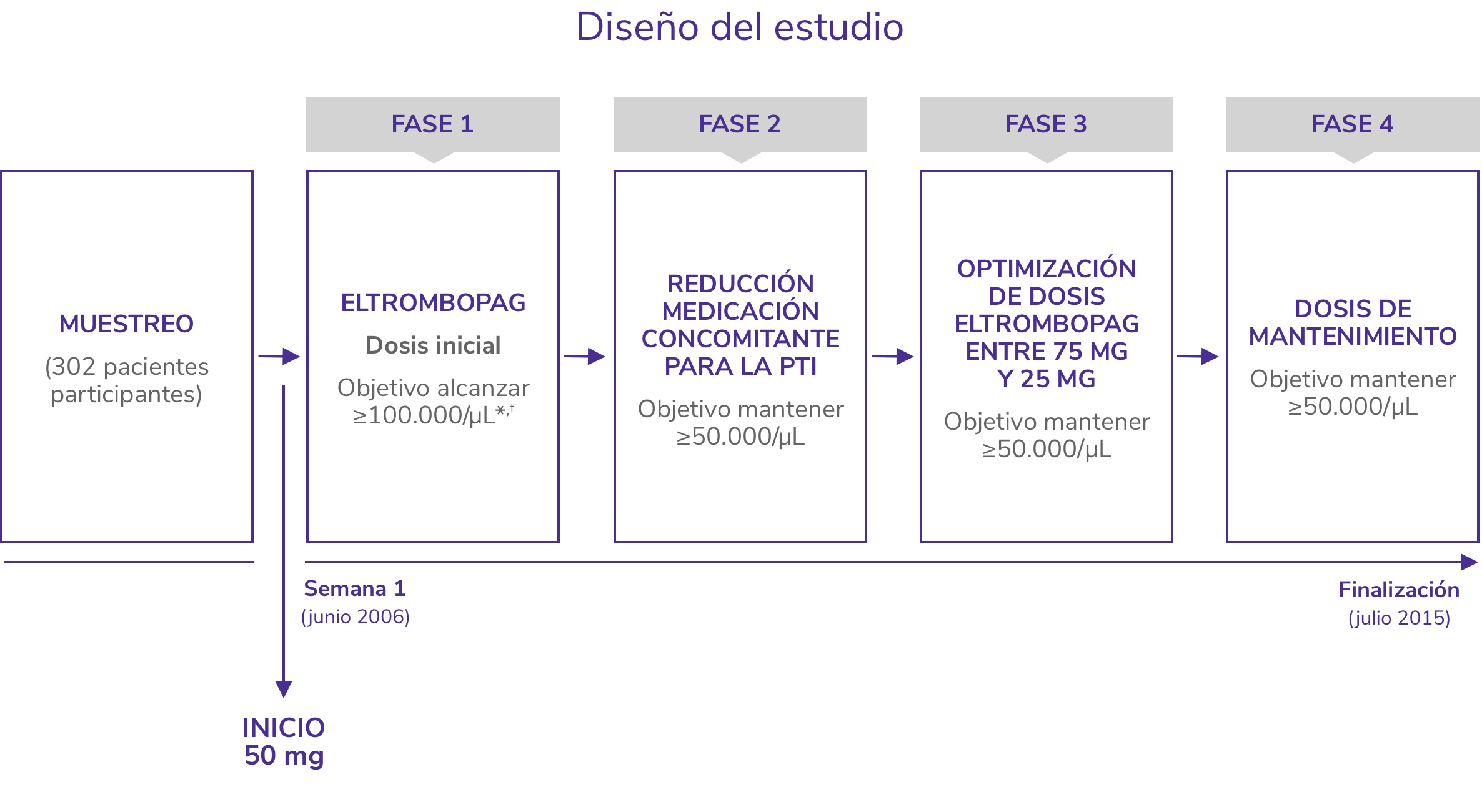
*Pacientes en ambos brazos recibieron SOC según las normas locales de tratamiento incluyendo pero sin limitarse a corticoides, IgIV, danazol, azatioprina, micofenolatom anti-D, ciclosporina, ciclofosfamida, rituximab y vincristina/vinblastina.
†Eltrombopag de inició a 50 mg/día.
SOC: standard of care
RAISE2
Estudio de fase 3, aleatorizado, doble ciego, controlado con placebo
- Incluyó a 197 adultos con PTI previamente tratada y recuento basal de plaquetas <30 x 109/L.
- Los pacientes recibieron tratamiento estándar local más REVOLADE® 50 mg una vez al día o placebo durante 6 meses.
- Las modificaciones de dosis se basaron en la respuesta plaquetaria individual, hasta un máximo de 75 mg una vez al día y un mínimo de 25 mg una vez al día.
- La variable principal fue la probabilidad de respuesta (definida como un recuento de plaquetas de ≥50 x 109/L y ≤400 x 109/L) durante el tratamiento.
- El 79% de los pacientes tratados con REVOLADE® respondieron al tratamiento al menos una vez durante el estudio frente al 28 % con placebo.
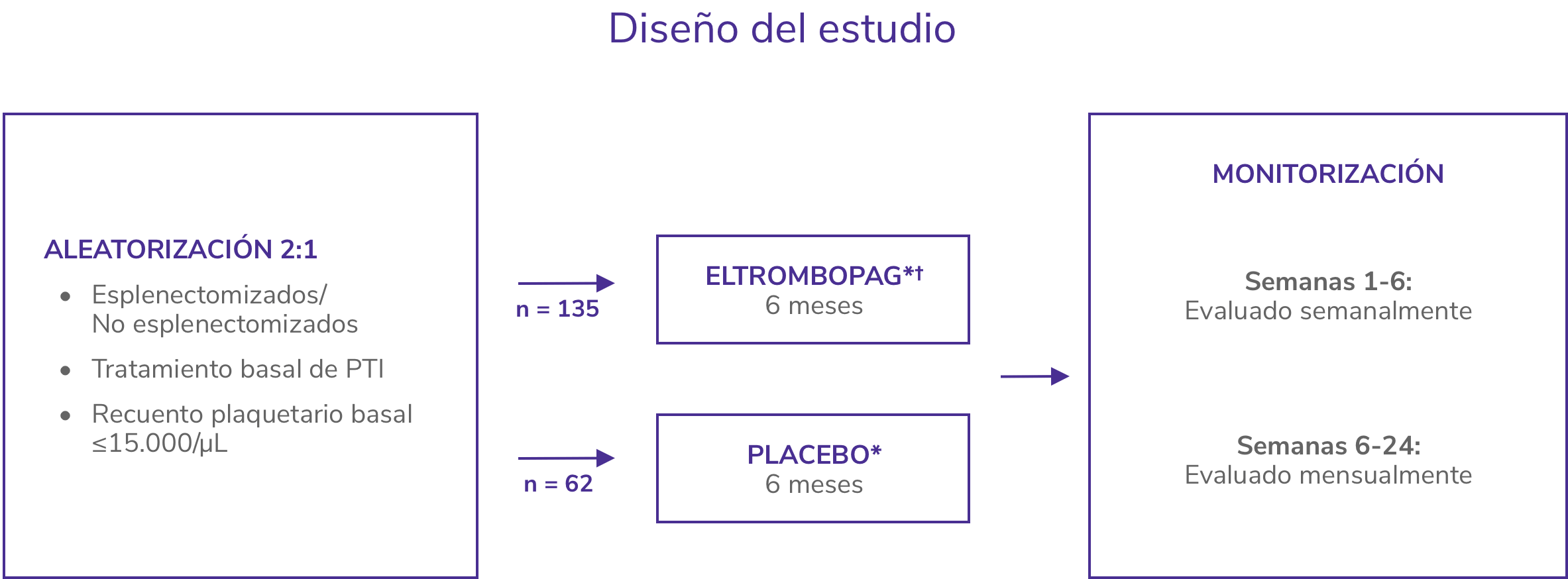
SOC: standard of care.
*Los pacientes recibieron SOC en ambos brazos, según las normas locales de tratamiento, incluyendo pero no limitado a corticosteroides. * Eltrombopag de inició a 50 mg/día.
PTI: trompocitopenia inmune primaria.
PETIT4,5
Estudio de 3 partes, de cohorte escalonada, abierto y doble ciego, aleatorizado, y controlado con placebo
- Incluyó a 67 niños ≥ 1 año con PTI de más de 6 meses de duración, en recaída o refractaria.
- Los pacientes fueron asignados al azar 2:1 al tratamiento con REVOLADE® (n = 45) o placebo (n = 22) durante 7 semanas.
- Se permitió el uso concomitante de una terapia estable de mantenimiento de la PTI (p. ej., corticosteroides).
- Al inicio del estudio:
- El 51 % de los pacientes tenían recuentos de plaquetas ≤15 x 109/L.
- El 84 % de los pacientes tratados con REVOLADE® y el 86 % de los pacientes tratados con placebo habían recibido >2 terapias previas para PTI.
- 5 pacientes en el grupo REVOLADE® y ninguno en el grupo placebo habían sido esplenectomizados previamente.
- La variable principal fue la proporción de pacientes que alcanzaron el recuento de plaquetas ≥50 x 109/L al menos una vez entre las semanas 1 y 6 en el periodo aleatorizado, doble ciego del estudio, en ausencia de terapia de rescate.
- La fase doble ciego fue seguida por una fase abierta en la que los pacientes recibieron tratamiento con REVOLADE® durante un periodo de hasta 24 semanas.
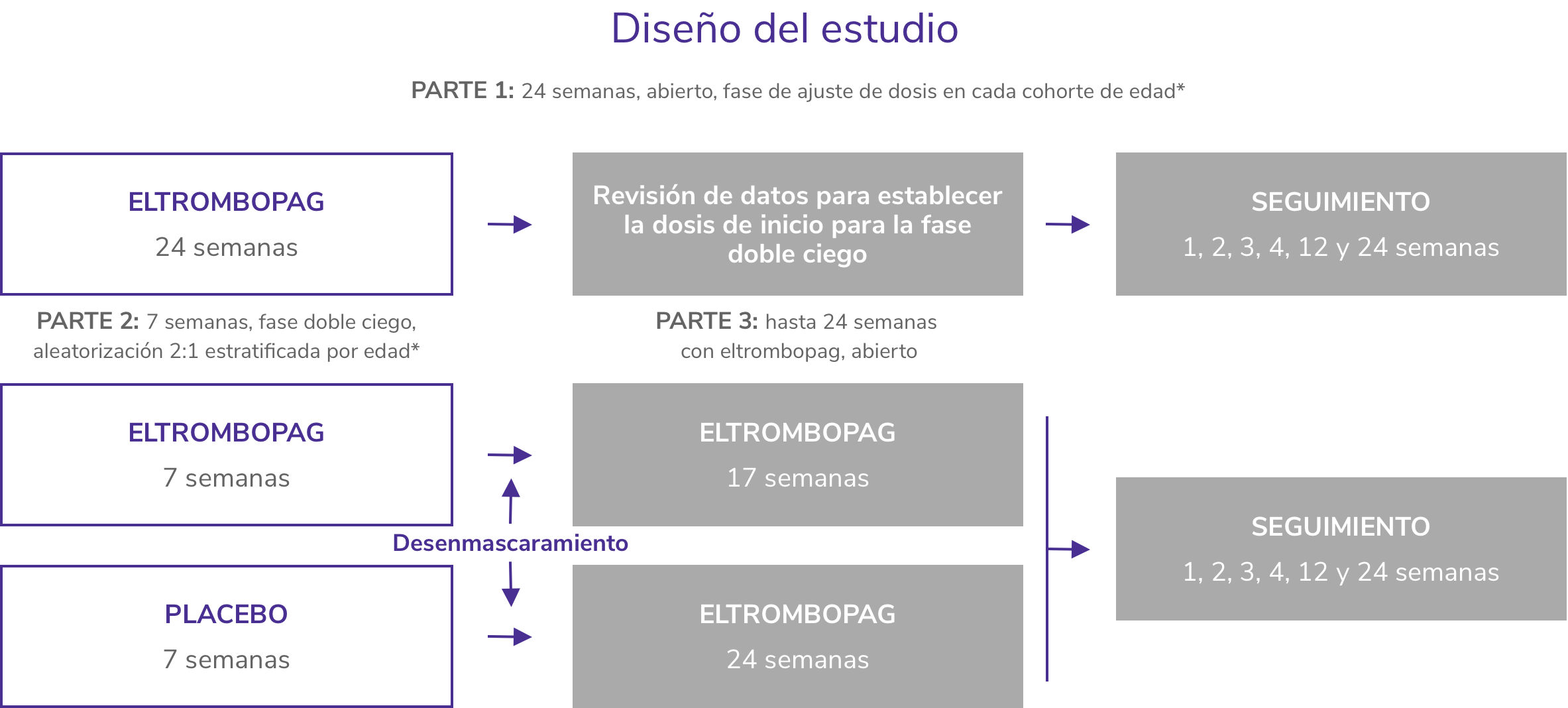
*Cohortes de edad: 12-17 años; 6-11 años y 1-5 años de edad.
PETIT26
Estudio fase 3, de dos partes, una fase doble ciego controlado con placebo de 13 semanas, seguida de una fase abierta de 24 semanas para evaluar la eficacia y seguridad de REVOLADE®
- Incluyó a 92 niños ≥1 año con PTI crónica en recaída o refractaria.
- Los pacientes fueron asignados al azar 2:1 al tratamiento con REVOLADE® (n = 63) o placebo (n = 29).
- Se permitió el uso concomitante de una terapia estable de mantenimiento de la PTI (p. ej., corticosteroides).
- Al inicio del estudio:
- El 62 % de los pacientes tenían recuentos de plaquetas ≤15 x 109/L.
- El 73 % de los pacientes tratados con REVOLADE® y el 90 % de los pacientes tratados con placebo habían recibido >2 terapias previas para PTI.
- 4 pacientes en el grupo REVOLADE® y ninguno en el grupo placebo habían sido esplenectomizados previamente.
- La variable principal fue la proporción de pacientes que alcanzaron el recuento de plaquetas ≥50 x 109/L durante ≥6 semanas entre las semanas 5 y 12 en el periodo aleatorizado, doble ciego del estudio en ausencia de terapia de rescate.
- La fase doble ciego fue seguida por una fase abierta con REVOLADE® de 24 semanas.
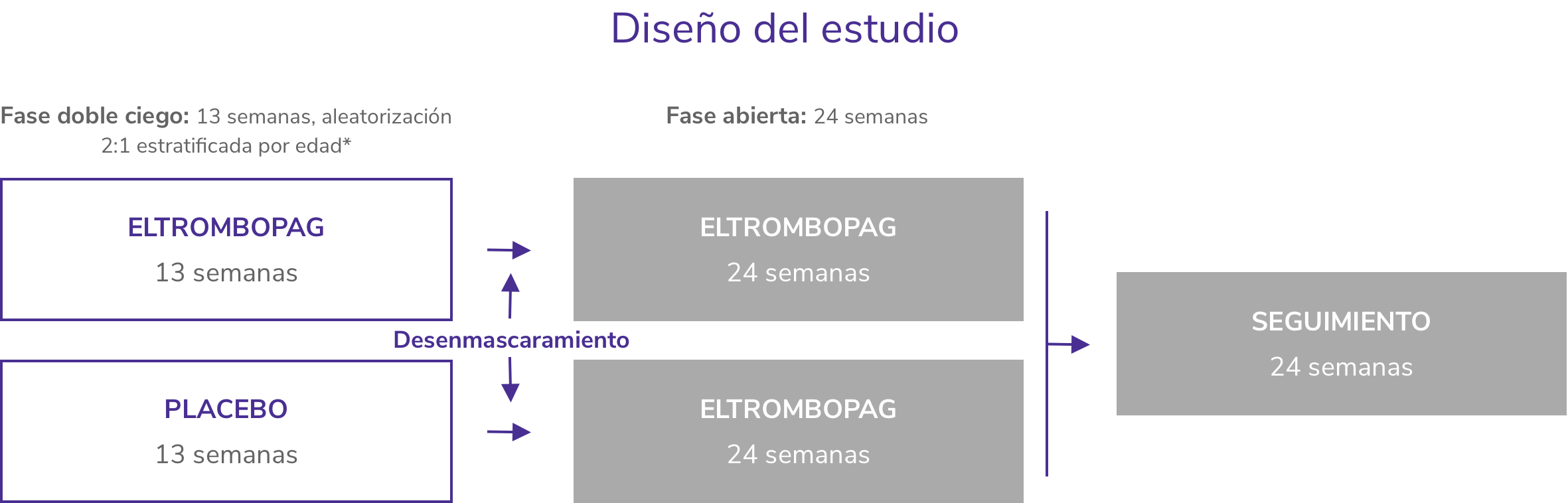
*Cohortes de edad: 12-17 años; 6-11 años y 1-5 años de edad.
PTI: trompocitopenia inmune primaria.
Referencias:
1. Grupo de Trabajo de la SEHH y GEPTI. Directrices de diagnóstico, tratamiento y seguimiento de la PTI. 2021. Disponible en: https://www.gepti.es/images/stories/recursos/2022/02/GUIA-PTI-2021.pdf
2. Abrahamson PE, et al. The incidence of idiopathic thrombocytopenic purpura among adults: a population-based study and literature review. Eur J Haematol. 2009;83(2):83-9.
3. Hedman A, Henter JI, Hedlund I, et al. Prevalence and treatment of chronic idiopathic thrombocytopenic purpura of childhood in Sweden. Acta Paediatr. 1997;86(2):226-7.


