La evidencia apoya los beneficios del inicio temprano de terapias de 2L6
- Se recomienda evitar el uso a largo plazo de los corticosteroides7. Tras la 1L con corticosteroides, deben evitarse ciclos adicionales con estos agentes8.
- El objetivo de iniciar el tratamiento de 2L es conseguir reducir la toxicidad de los tratamientos inmunosupresores a largo plazo8.

Un cambio temprano de corticosteroides a AR-TPO tiene doble ventaja9:
- Evita el abuso de corticosteroides.
- Mejora los resultados clínicos a largo plazo.
REVOLADE® está indicado para el tratamiento de la PTI en pacientes adultos que son refractarios a otros tratamientos (por ejemplo, corticosteroides, inmunoglobulinas)3.

Con un estudio de extensión de casi 9 años, evaluando la seguridad y eficacia a largo plazo en PTI en adultos1, REVOLADE® cuenta con una amplia experiencia demostrada.
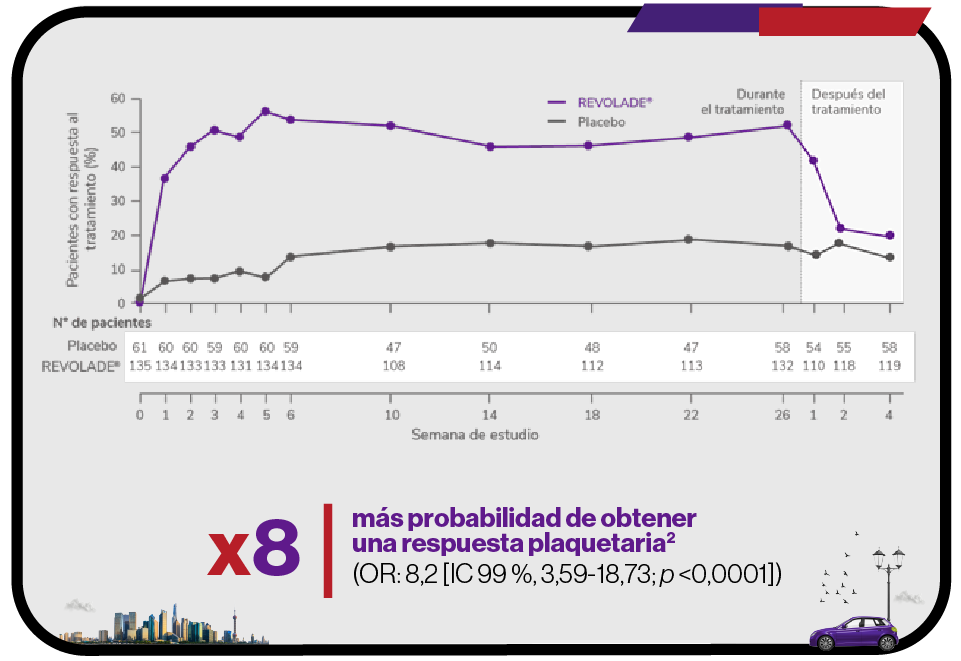
En pacientes adultos con PTI que son refractarios a un tratamiento previo, REVOLADE® proporciona una respuesta rápida, sostenida, elevada y significativa1,2
Rápida y sostenida1
Respuesta desde la primera semana y con un seguimiento de 8,8 años1
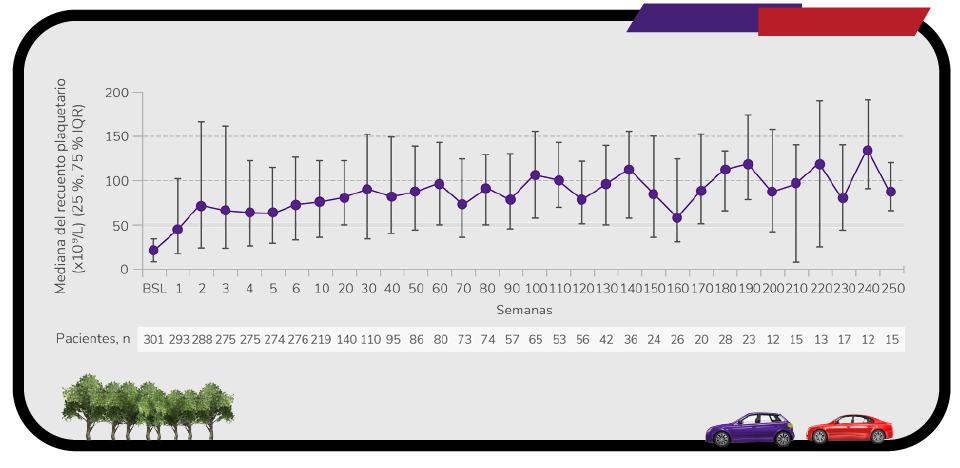
Elevada1
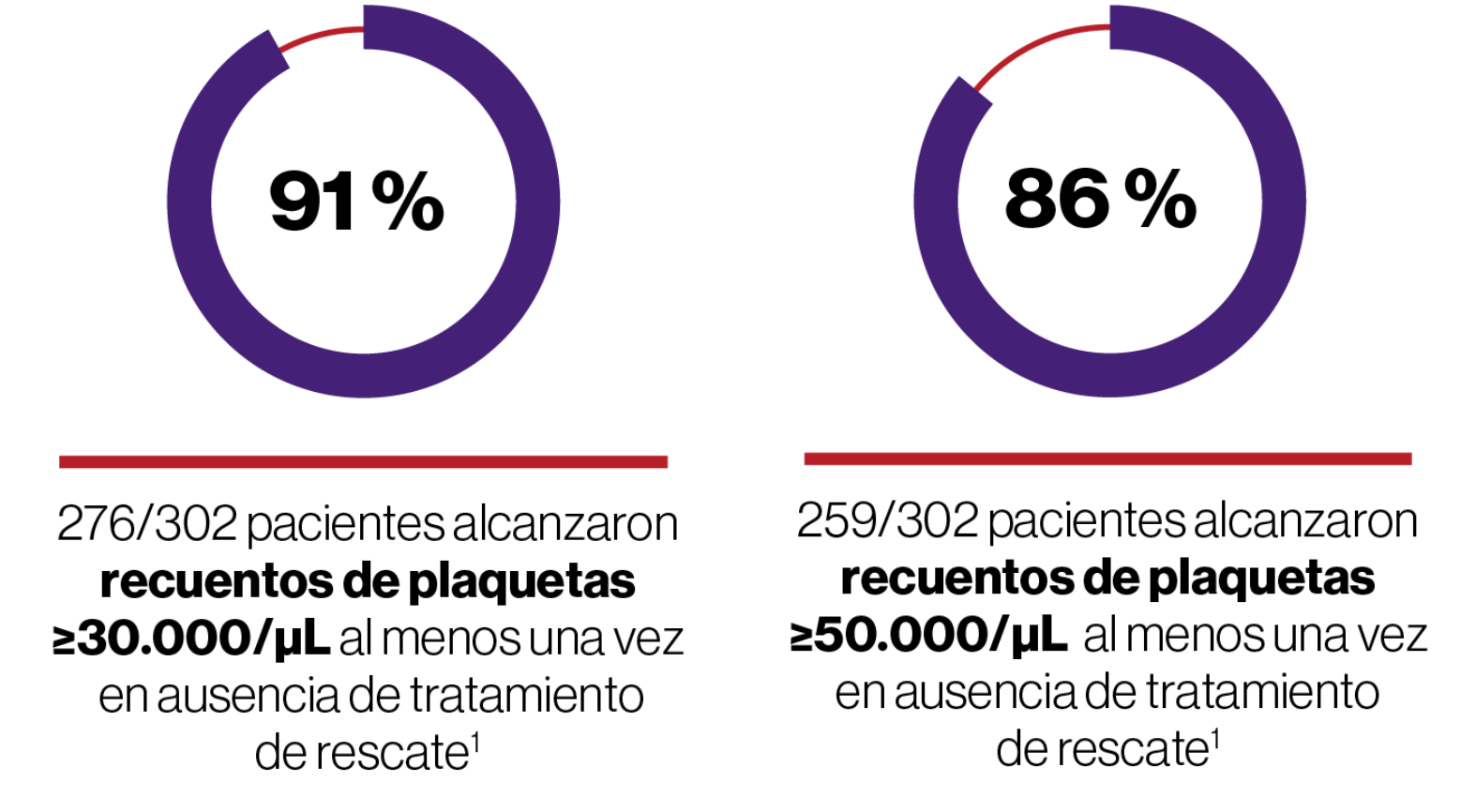
Significativa2
Respuesta de los pacientes con REVOLADE® o placebo durante los 6 meses del tratamiento2
REVOLADE® proporciona una reducción de las hemorragias1,2

REVOLADE® reduce la necesidad de medicación concomitante1,2

En pacientes adultos con PTI que son refractarios a un tratamiento previo, REVOLADE ® es bien tolerado, incluso en el tratamiento a largo plazo1,2
- El perfil de seguridad a más largo plazo estudiado en PTI (hasta 8,8 años): estudio EXTEND1.
- El estudio EXTEND demuestra que incluso utilizando REVOLADE® durante años, puede ser no solo consistente en eficacia, sino tolerable y seguro en la mayoría de los pacientes1.
- No se identificaron nuevas alertas de seguridad respecto a los efectos adversos descritos en el estudio RAISE a 6 meses1.
Efectos adversos registrados en el estudio RAISE2
Según el estudio RAISE, la incidencia de efectos adversos fue similar en ambos grupos de tratamiento. Los efectos adversos registrados en ambos grupos fueron en su mayoría de grado 1 y 22.
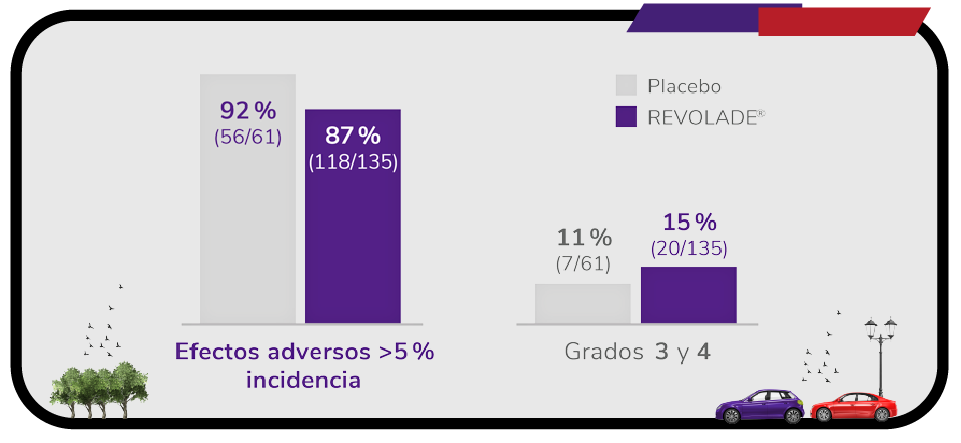
Efectos adversos durante el estudio EXTEND1
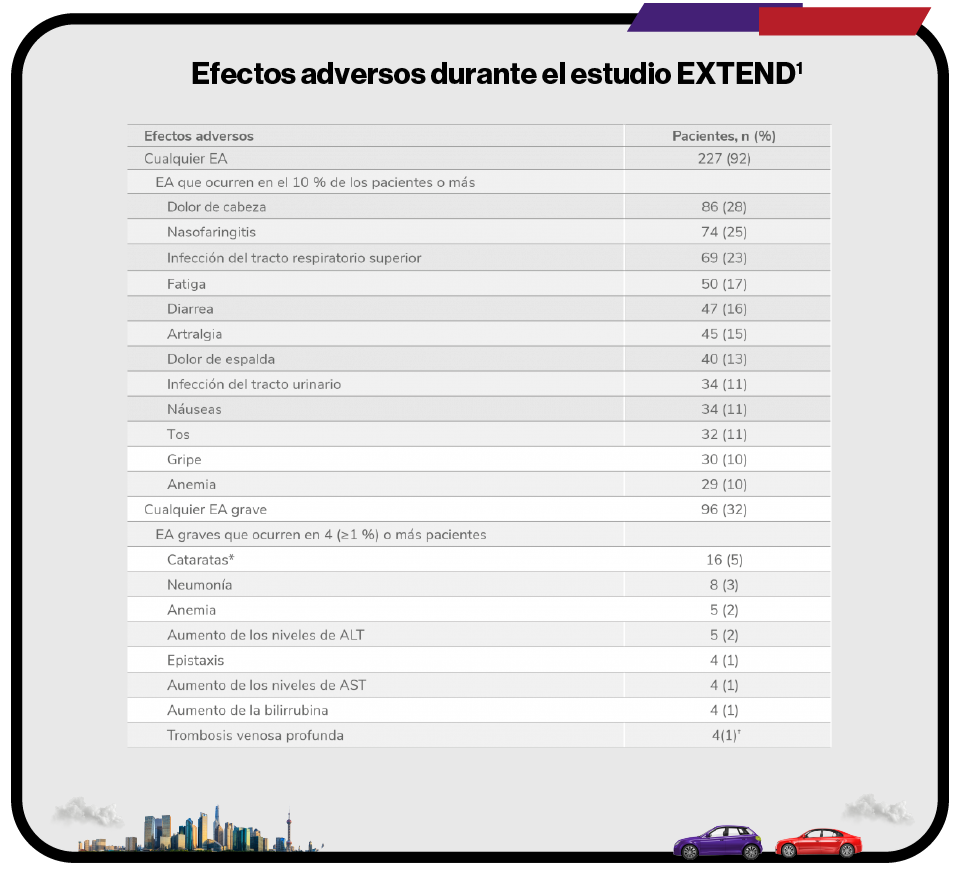
Efectos adversos durante la terapia (n = 302).
*El protocolo del estudio requería que las cataratas fueran reportadas como EA grave.
†Las trombosis venosas profundas indicadas se categorizaron por el término principal. Un paciente tuvo 2 trombosis venosas profundas. A otro paciente se le clasificó como que había sufrido una trombosis y más tarde se consideró que sufrió una trombosis venosa profunda.
Respuesta sostenida libre de tratamiento10
REVOLADE® permite lograr una respuesta sostenida sin tratamiento10

- Aproximadamente el 42 % de los pacientes se somete a una reducción progresiva exitosa y discontinuación de REVOLADE® después de lograr una respuesta estable10.
Respuesta sostenida sin tratamiento con REVOLADE® hasta el mes 12 (conjunto de análisis completo)10
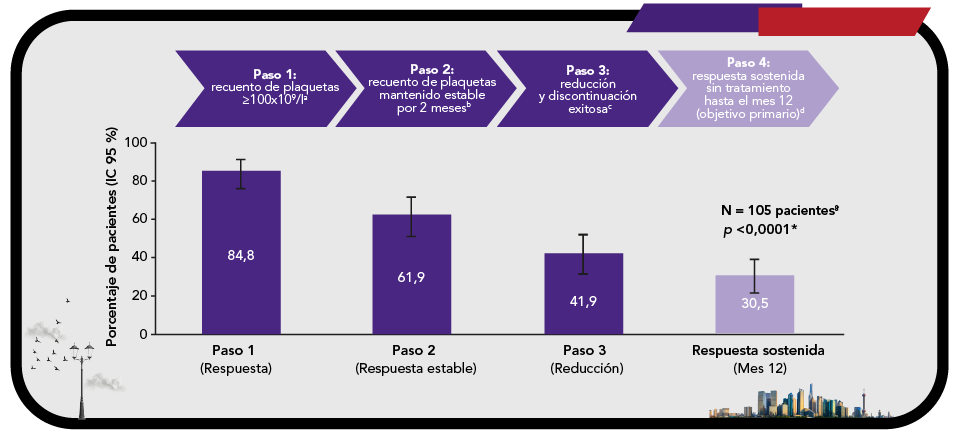
*Indica significación estadística (unilateral) al nivel de 0,05. Se utilizó la prueba de Clopper-Pearson para comprobar si la proporción de respondedores era >15 %.
aAlcanzado al menos una vez.
bRecuento de plaquetas ≥70x109/l durante 2 meses después de alcanzar 100x109/l.
cDisminución gradual del fármaco hasta la discontinuación del tratamiento, recuento de plaquetas ≥30x109/l mantenido sin eventos hemorrágicos ni terapia de rescate.
dRecuento de plaquetas ≥30x109/l mantenido sin eventos hemorrágicos ni terapia de rescate.
En general, REVOLADE® fue bien tolerado, sin efectos adversos inesperados10.
Los efectos adversos de cualquier grado más frecuentes fueron10:
| Grado≥3 | |
| 21 % cefalea | 1 % |
| 17 % trombocitopenia | 10,5 % |
| 11 % petequias | 1 % |
REVOLADE® permite lograr una respuesta sostenida sin tratamiento.
Estudio de fase II con un solo grupo para evaluar la seguridad y eficacia de REVOLADE® y su capacidad para inducir una respuesta sostenida después de la discontinuación del tratamiento3,10
- Incluyó a 105 pacientes adultos con PTI que recayeron o no respondieron al tratamiento de 1L con corticosteroides.
- La mediana de edad (IQR) fue de 46 (30-65) años; el 61 % eran mujeres.
- Los pacientes que alcanzaron un recuento de plaquetas ≥100x109/l y mantuvieron el recuento de plaquetas alrededor de 100x109/l durante 2 meses (ningún recuento <70x109/l) fueron aptos para la retirada gradual y la suspensión permanente del tratamiento con REVOLADE® .
- La variable principal fue la proporción de pacientes con respuesta sostenida sin tratamiento hasta el mes 12.
- Para que se considerara que había logrado una respuesta sostenida sin tratamiento, el paciente tenía que mantener recuentos de plaquetas ≥30x109/l, sin eventos hemorrágicos o sin el uso de tratamiento de rescate, tanto durante el periodo de reducción gradual del tratamiento como tras la suspensión del tratamiento hasta el mes 12.
Aproximadamente 1 de cada 3 pacientes (30,5 %) experimenta una respuesta sostenida hasta el mes 12 después de la disminución gradual y la interrupción del tratamiento con REVOLADE®, incluso después de una exposición relativamente corta10.

Para tu comodidad, también podrás disponer de un resumen de esta evidencia en formato PDF. Esperamos que te resulte útil.
*En pacientes pediátricos y adultos que son refractarios a un tratamiento previo.
1L: primera línea; 2L: segunda línea; ALT: alanina aminotransferasa; AR-TPO: agonistas del receptor de la trombopoyetina; AST: aspartato aminotransferasa; BSL: basal; EA: efectos adversos; IC: intervalo de confianza; IQR: rango intercuartílico; OR: odds ratio; PTI: trombocitopenia inmune primaria.
Referencias:
1. Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536.2017.
2. Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402.
3. Ficha técnica de REVOLADE®.
4. Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015;2(8):e315-e325.
5. Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-1658.
6. Cuker A, et al. Early initiation of second‑line therapy in primary immune thrombocytopenia: insights from real‑world evidence. Ann Hematol. 2023;102(8):2051-2058.
7. Provan D, et al. Updated international consensus report on the investigation and management of primary immune thrombocytopenia. Blood Adv. 2019;3:3780-3817.
8. Grupo de Trabajo de la SEHH y GEPTI. Directrices de diagnóstico, tratamiento y seguimiento de la PTI. 2020. Sociedad Española de Hematología y Hemoterapia (SEHH).
9. Carpenedo C, et al. Second-line administration of thrombopoietin receptor agonists in immune thrombocytopenia: Italian Delphi-based consensus recommendations. Ther Adv Hematol. 2021;12:20406207211048361.
10. Cooper N, et al. Sustained response off treatment in eltrombopag-treated patients with ITP who are Refractory or relapsed after first-line steroids: primary analysis of the phase II TAPER trial. HemaSphere. 2022;6:(S3):S292-S293.


