Concepto
La aplasia medular grave (AMG) es un trastorno autoinmune en el que los linfocitos T citotóxicos autorreactivos atacan al componente hematopoyético de la médula ósea.1
Se desconoce la causa o el antígeno específico que la provoca.1
Epidemiología
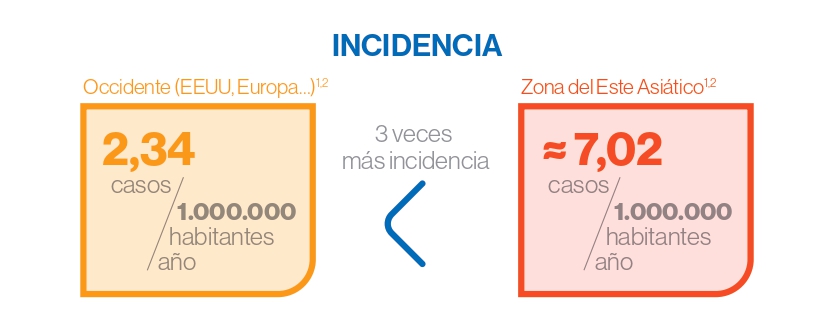
La AMG tiene una distribución bifásica, con más incidencia en adultos jóvenes y en pacientes mayores.1,2
Referencias:
1. Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019.
2. Young NS, Kaufman DW. The epidemiology of acquired aplastic anemia. Haematologica. 2008;93:489–92.
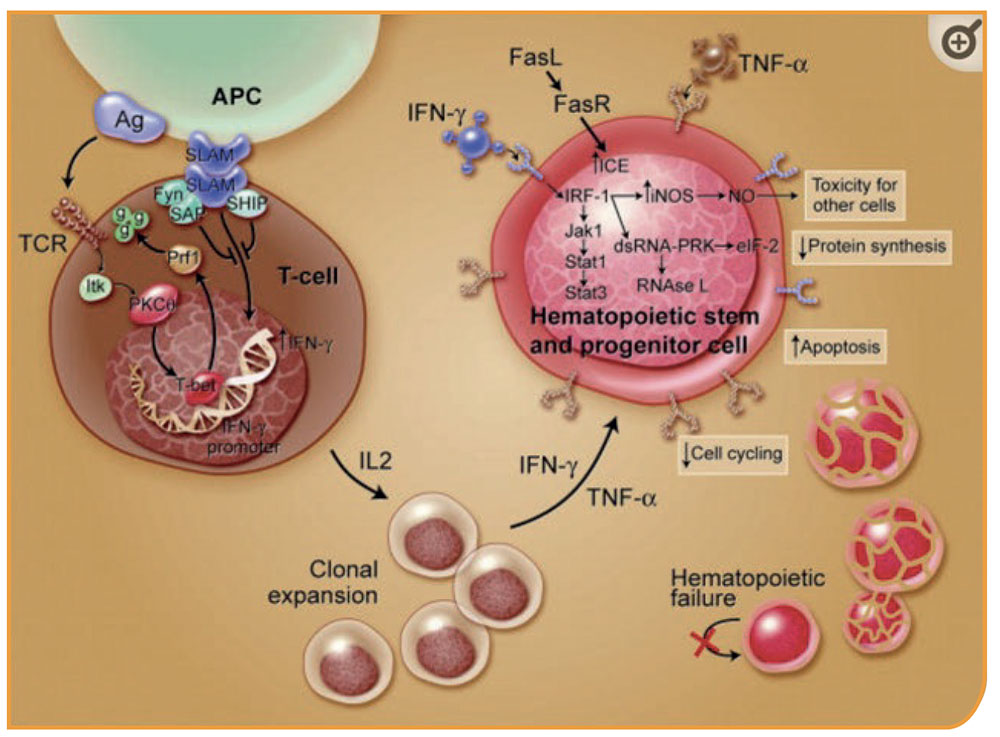
Destrucción inmune de la hematopoyesis: los antígenos son presentados a los linfocitos T a través de las células presentadoras de antígenos (CPAs), que inducen a las células T a activarse y proliferar. T-bet, un factor de transcripción, se une a la región promotora del gen interferón-γ (INF-γ) e induce la expresión del gen. SAP se une a Fyn y modula la actividad de SLAM en la expresión de INF-γ, reduciendo la transcripción del gen. Los pacientes con aplasia medular muestran una expresión de T-bet constitutiva y niveles bajos de SAP. INF-γ y TNF-α regulan al alza la expresión de los receptores celulares de otras células T así como el receptor Fas. Un aumento en la producción de interleucina-2 induce una expansión policlonal de las células T. La activación del receptor Fas por el ligando Fas induce la apoptosis de las células diana. Algunos efectos de IFN-γ son mediados a través de IRF-1, que inhibe la transcripción de genes celulares y la entrada en el ciclo celular. IFN-γ es un potente inductor de diversos genes celulares, incluyendo la sintasa de óxido nítrico (NOS) inducible; la producción del gas tóxico óxido nítrico puede contribuir a difundir aún más los efectos tóxicos. Estos eventos conducen, finalmente, a una reducción en los ciclos celulares y a muerte celular por apoptosis.
Extraído de Young NS et al. 20061
Referencias:
1. Young NS, Calado RT, Scheinberg P. Current concepts in the pathophysiology and treatment of aplastic anemia. Blood. 2006 Oct 15;108(8):2509-19.
El diagnóstico de la AMG generalmente se realiza en el contexto de una pancitopenia y una médula ósea hipocelular. De esta manera, el proceso de diagnóstico suele ser el siguiente:1-4
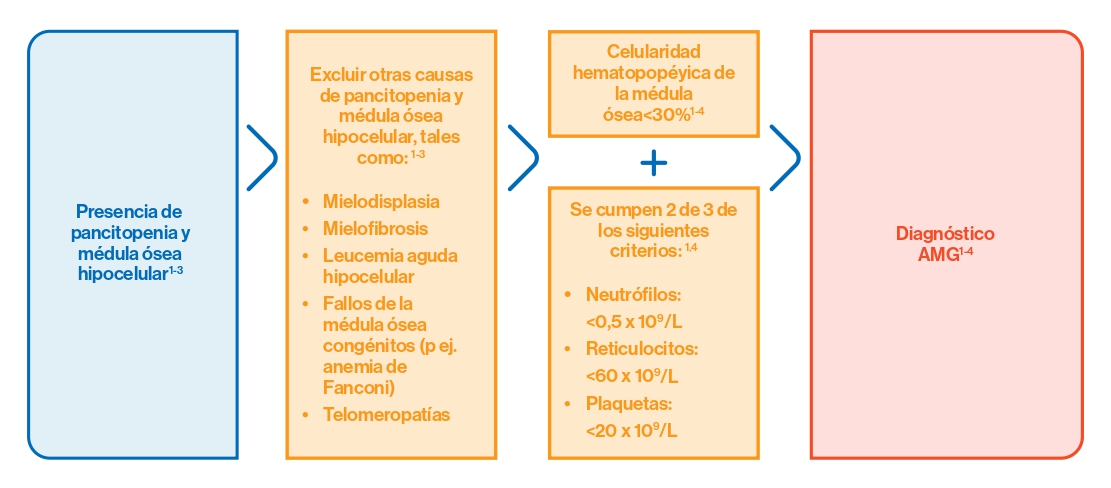
- También se debe tener en cuenta que un 10% de los pacientes con AMG presentan anomalías citogenéticas.1-3
Si los criterios de la AMG se cumplen, el tratamiento debe comenzar sin ningún retraso.
Una vez se ha confirmado el diagnóstico y la gravedad de la enfermedad también se ha establecido, se debería empezar con la búsqueda de donante familiar HLA-idéntico o de un donante no emparentado HLA 10/10.1
Referencias:
1. Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019.
2. Rovo A, et al. Current approach for the diagnosis of Aplastic Anemia. Curr Drug Targets. 2016;17:1.
3. Barone A, Lucarelli A, Onofrillo D, et al. Diagnosis and management of acquired aplastic anemia in childhood. Guidelines from the Marrow Failure Study Group of the Pediatric Haemato-Oncology Italian Association (AIEOP). Blood Cells Mol Dis. 2015;55:40–7.
4. Camitta BM, Thomas ED, Nathan DG, et al. Severe aplastic anemia: a prospective study of the effect of early marrow transplantation on acute mortality. Blood. 1976;48:63–70.
Tratamientos de primera línea
La elección de tratamiento de 1ª línea depende de la edad del paciente y de la disponibilidad de donante hermano HLA-idéntico. Los tratamientos estándar son:1

Tratamientos de segunda línea
La elección del tratamiento de segunda línea estará basada principalmente por la edad, las comorbilidades, y la disponibilidad de un donante familiar HLA idéntico (MRD) o no emparentado HLA 10/10 (MUD).1
Algunas opciones en estos pacientes son: trasplante MRD, MUD, eltrombopag, 2º ciclo de TIS, y otras.1
Referencias:
1. Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019. 2. Bacigalupo A, Boyd A, Slipper J, et al. Foscarnet in the management of cytomegalovirus infections in hematopoietic stem cell transplant patients. Expert Rev AntiInfect Ther. 2012;10:1249–64. 3. Peffault de Latour R. Transplantation for bone marrow failure: current issues. Hematology Am Soc Hematol Educ Program. 2016;2016(1):90–8. 4. Konopacki J, Porcher R, Robin M, et al. Long-term follow up after allogeneic stem cell transplantation in patients with severe aplastic anemia after cyclophosphamide plus antithymocyte globulin conditioning. Haematologica. 2012;97:710–6. 5. Marsh JC, Gupta V, Lim Z, et al. Alemtuzumab with fludarabine and cyclophosphamide reduces chronic graft-versus-host disease after allogeneic stem cell transplantation for acquired aplastic anemia. Blood. 2011;118:2351–7. 6. Scheinberg P, Nunez O, Weinstein B, et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia. N Engl J Med. 2011;365:430–8. 7. Marsh JC, Bacigalupo A, Schrezenmeier H, et al. Prospective study of rabbit antithymocyte globulin and cyclosporine for aplastic anemia from the EBMT Severe Aplastic Anaemia Working Party. Blood. 2012;119:5391–6. 8. Peffault de Latour R, Tabrizi R, Marcais A, et al. Nationwide survey on the use of horse antithymocyte globulins (ATGAM) in patients with acquired aplastic anemia: A report on behalf of the French Reference Center for Aplastic Anemia. Am J Hematol. 2018;93:635–42. 9. Dufour C, Pillon M, Passweg J, et al. Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party ofthe European Group for Blood and Marrow Transplantation. Haematologica. 2014;99:1574–81. 10. Dufour C, Pillon M, Sociè G, et al. Outcome of aplastic anaemia in children. A study by the severe aplastic anaemia and paediatric disease working parties of the European group blood and bone marrow transplant. Br J Haematol. 2015a;169:565–73. 11. Scheinberg P, Young NS. How I treat acquired aplastic anemia. Blood. 2012;120:1185–96.

