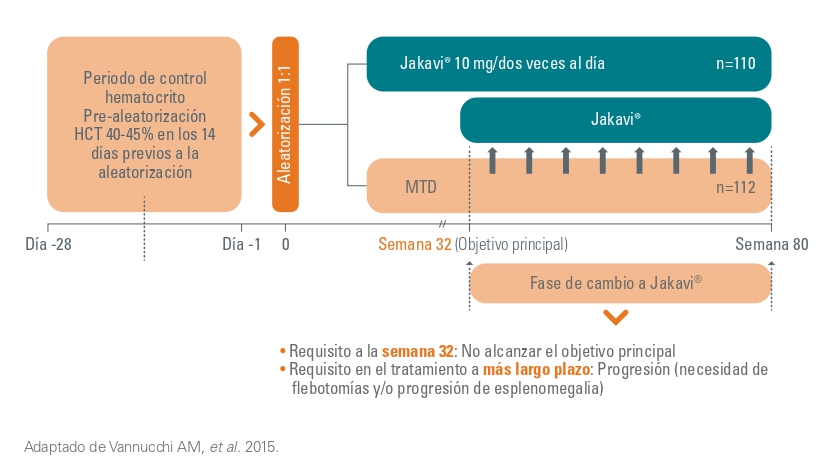
Diseño de los estudios RESPONSE
RESPONSE I/II: estudios de fase III, aleatorizados, abiertos.
Objetivo principal
- Proporción de pacientes cuyo hematocrito se controló sin necesidad de flebotomías desde la semana 8 hasta la semana 32 (sin más de una flebotomía necesaria entre la aleatorización y la semana 8) y cuyo volumen del bazo se redujo en ≥35% desde el inicio en la semana 32.1
Los pacientes que no alcanzaron el objetivo a la semana 32 se permitió el cruce de tratamiento.
Objetivos secundarios
- Durabilidad de la respuesta primaria en la semana 48.
- Respuesta hematológica completa en la semana 48 y/o progresión de la esplenomegalia.
- Duración de respuesta. • Mejoría de síntomas según el cuestionario MPN-SAF
- Seguridad.
Criterio de inclusión
- Resistencia o intolerancia a HU (criterios ELN), necesidad de flebotomías para el control del hematocrito, esplenomegalia y no tratamiento previo con un inhibidor JAK.
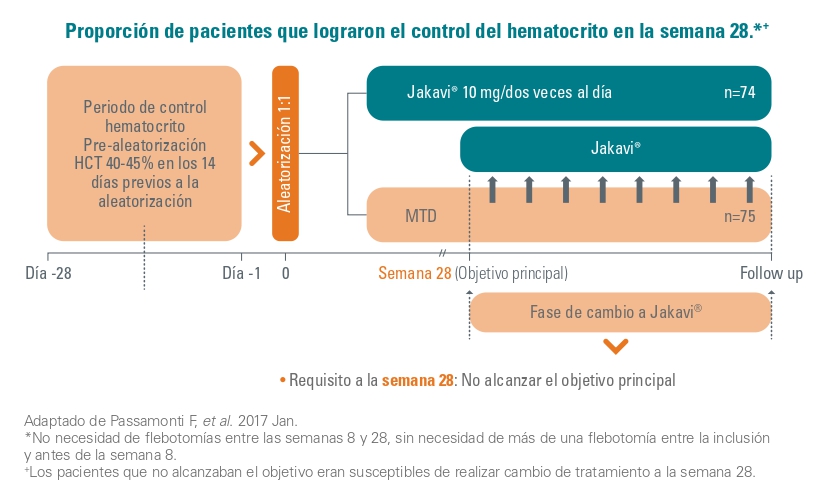
Objetivo principal
Objetivos secundarios
- Remisión hematológica completa en la semana 28.
- Durabilidad del control del hematocrito y la remisión hematológica completa (proporción de pacientes que lograron el control del hematocrito y la remisión hematológica completa en las semanas 52 y 80).
- Cambio en la necesidad de flebotomía con el tiempo.
- Cambio en el nivel de hematocrito a largo plazo.
- Cambio en el tamaño del bazo.
- Cambio en el estado ECOG.
- Supervivencia general y seguridad.
Criterio de inclusión
- Paciente resistente/intolerante a HU sin bazo palpable, sin tratamiento previo con inhibidor JAK y dependiente de flebotomías, Un paciente es dependiente de flebotomías cuando tiene:
- Hematocrito entre 40% y 45% con dos o más flebotomías con al menos 4 semanas de diferencia dentro de las 24 semanas pre-aleatorización, o
- Hematocrito >45% con al menos una flebotomía dentro de las 16 semanas antes de aleatorización.
1. Vannucchi AM et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Eng J Med. 2015;372(5):426-435.
2. Passamonti F. et al. Ruxolitinib for the treatment of inadequately controlled polycythaemia vera without splenomegaly (RESPONSE-2): a randomised. open label phase 3b study Lancet Oncol 2017 Jan; 18: 88-99.
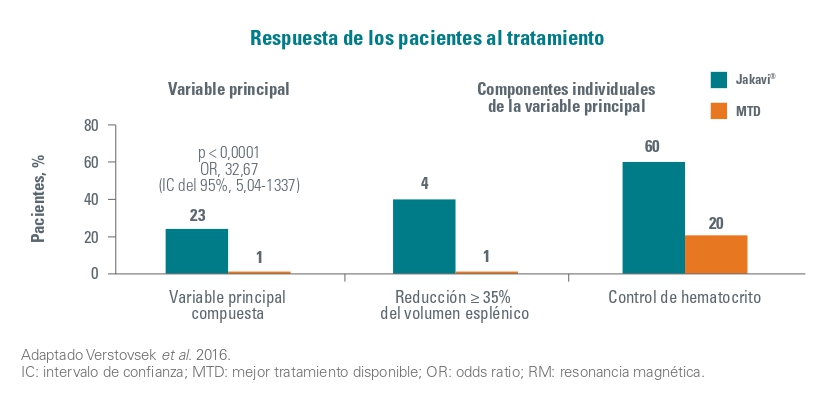
Eficacia
El objetivo principal del estudio fue el % de pacientes que lograron controlar el hematocrito y una respuesta esplénica en la semana 32. Debido a la falta de eficacia, la mayoría de los pacientes del grupo de MTD cambiaron de grupo para recibir Jakavi en la visita de la semana 32 o poco después.
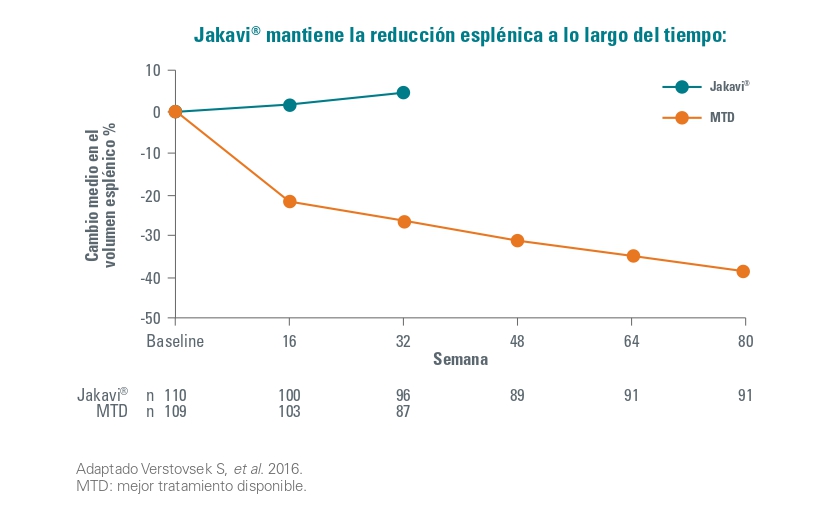
En la semana 80 un total de 25 pacientes (22,7%) habían logrado una respuesta primaria de acuerdo con la variable principal combinada. Respecto a las individuales, el 40% de pacientes alcanzaron una reducción del volumen esplénico y el 60% consiguieron un control del hematocrito.
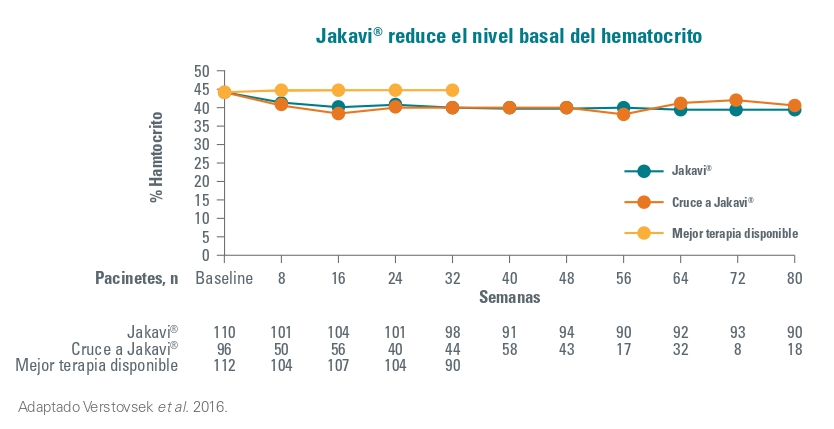
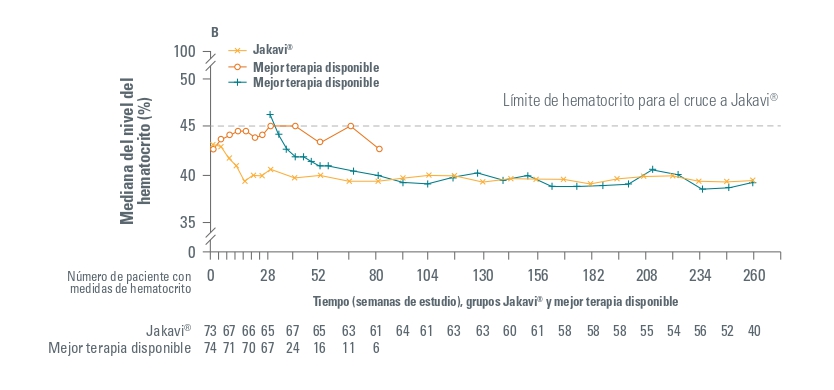
Además, el valor promedio del hematocrito en el grupo de Jakavi disminuyó < 45% y fue menor que en el grupo MTD (BAT) durante todo el estudio. Igualmente, los pacientes que cambiaron del grupo a MTD a Jakavi también redujeron el hematocrito.
Los pacientes que alcanzaron respuesta primaria en el grupo de Jakavi, consiguió mantener la respuesta al menso 80 semanas desde el momento que se alcanzó, con una probabilidad del 92%.
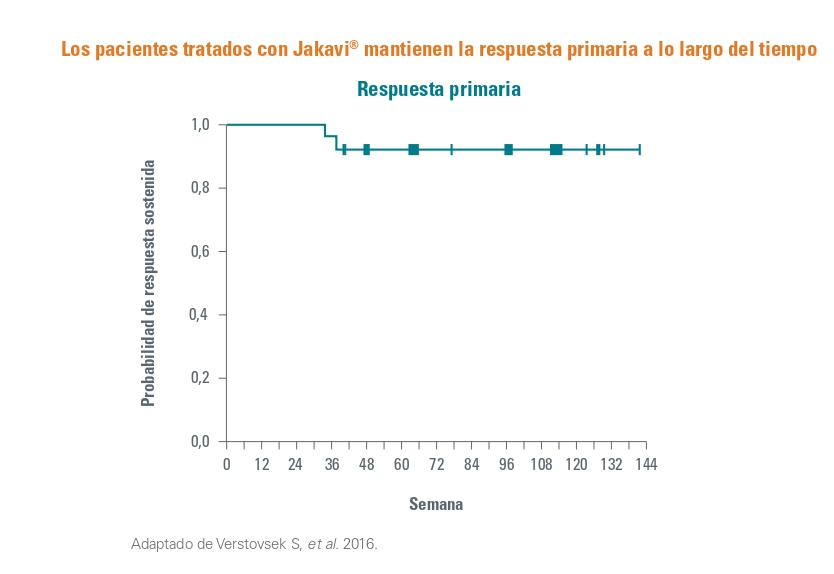
Del 40% de los pacientes del grupo Jakavi que lograron reducción esplénica, todos mantuvieron la respuesta a la semana 80.
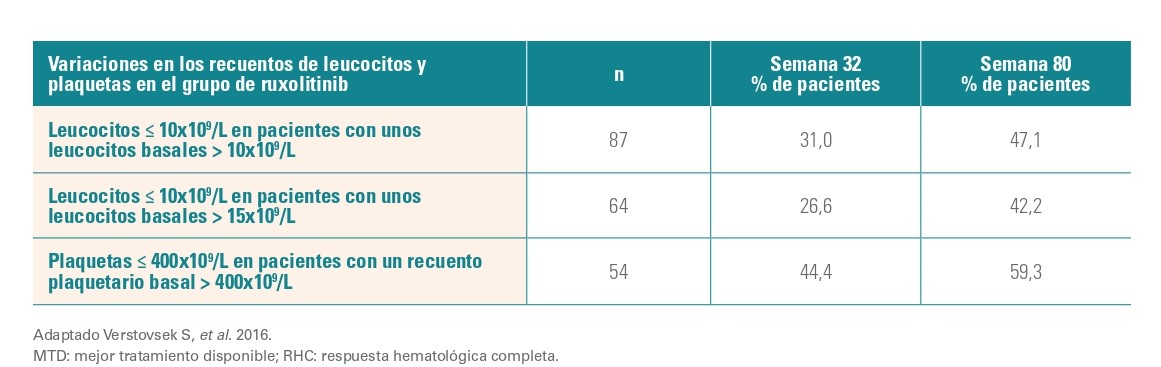
En la semana 32, el 23,6% de los pacientes del grupo de Jakavi y el 8,9% de los pacientes del grupo del MTD habían alcanzado una RHC. La probabilidad de mantener una RHC durante ≥80 semanas desde el momento en que se alcanzó la respuesta fue del 69%. El porcentaje de pacientes en los que se normalizaron los recuentos de leucocitos y plaquetas aumentó con el tiempo en el grupo tratado con Jakavi.
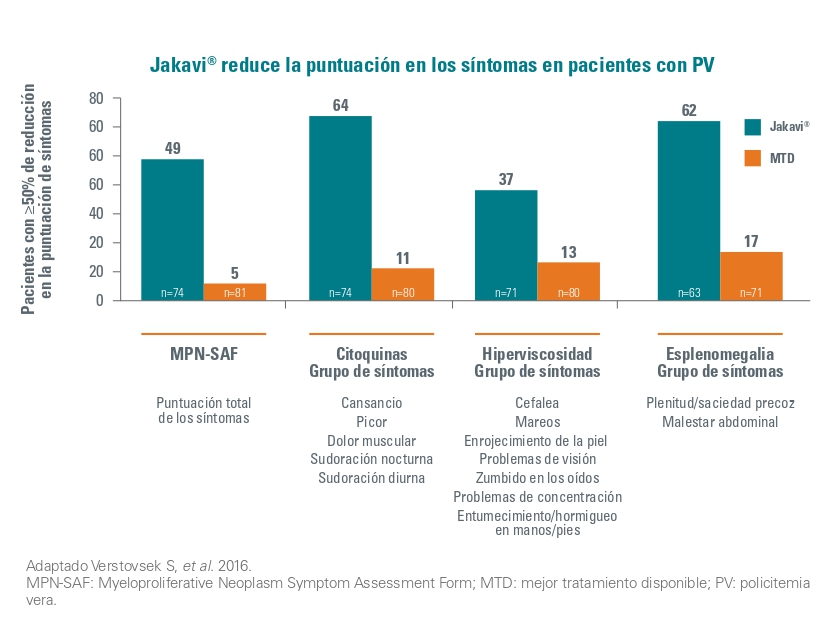
En cuanto a la sintomatología de la PV en la semana 32, un gran porcentaje de pacientes en el grupo de Jakavi alcanzaron una reducción y o igual al 50% en la puntuación de los síntomas:
Referencias:
1. Vannucchi AM et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Eng J Med. 2015;372(5):426-435.
2. Verstovsek S, et al. Ruxolitinib versus best available therapy in patients with polycythemia vera: 80-week follow-up from the RESPONSE trial. Haematologica. 2016 Jul;101(7):821-9
El control de hematocrito se logró en 46 (62 %) de los 74 pacientes tratados con Jakavi, contra 13 (19%) de los que recibieron la mejor terapia disponible (OR 7,28 [95 % IC 3,43-15,45]; p < 0,0001).
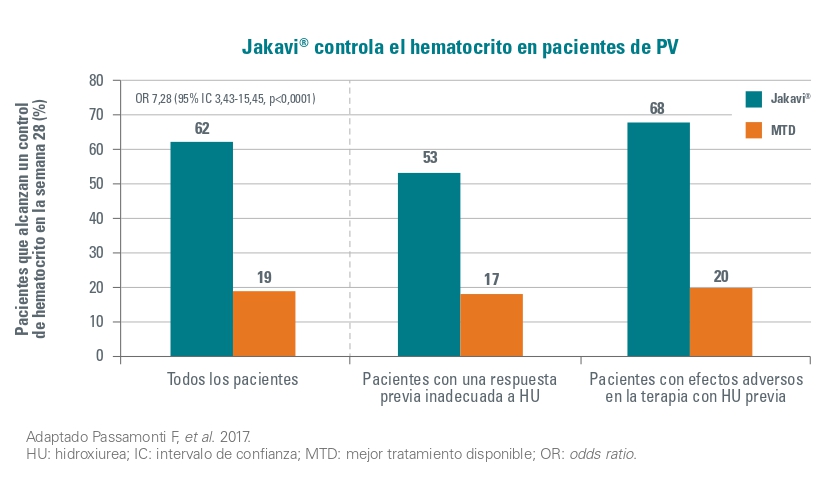
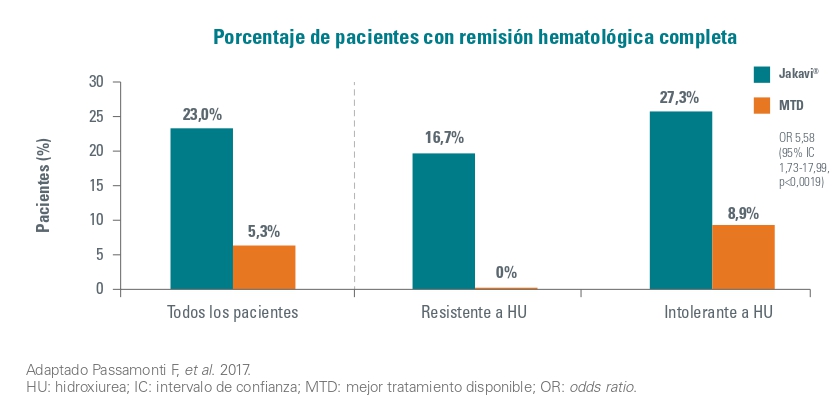
El 23% (17/74) de los pacientes aleatorizados a Jakavi alcanzaron respuesta hematológica completa en la semana 28, en comparación con el 5 % (4/74) en el grupo de mejor terapia disponible (OR 5,58 [95 % IC 1,73-17,99]; p = 0,0019).
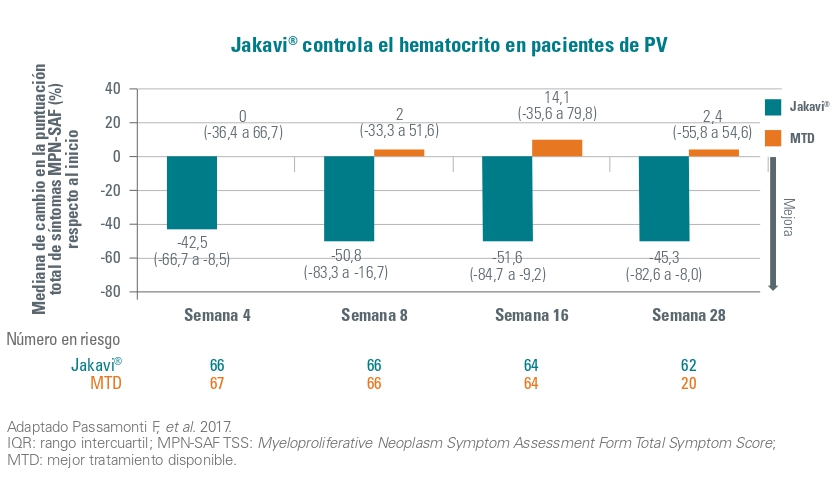
La mediana de cambio de porcentaje del MPN-SAF TSS desde la basal (donde valores negativos indican mejoría), fue de -45,3 % (IQR -82,6 a -8,0) para pacientes en el grupo de Jakavi y 2,4 % (-55,8 a 54,6) para pacientes en el grupo de mejor terapia disponible, en la semana 28.
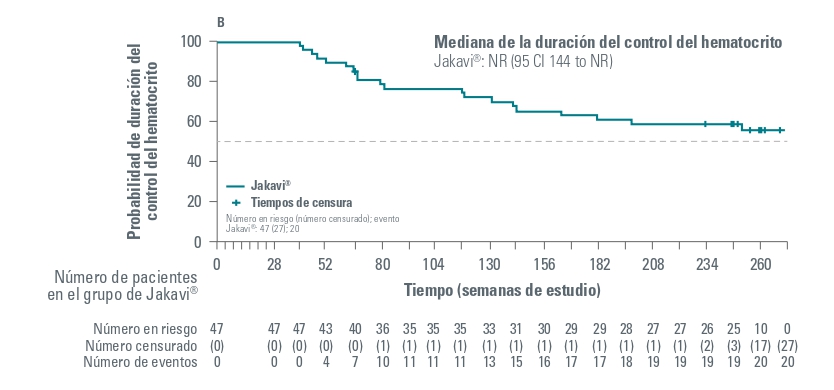
En el estudio RESPONSE-2, entre los pacientes que lograron una respuesta del Hto en la semana 28, se estimó que mantendrían la respuesta hasta la semana 80 el 78 % de los tratados con Jakavi.
- Se logró un control duradero del Hto (Hto controlado tanto en la semana 28 como en la semana 80) en 35 de los 74 (47%) pacientes tratados con Jakavi, en comparación con 2 de los 75 (3%) pacientes tratados con el MTD en la semana 80*.
- 18 de los 74 (24%) pacientes tratados con Jakavi, en comparación con 2 de los 75 (3%) pacientes tratados con el MTD lograron una remisión duradera según el hemograma en sangre periférica (control del Hto, leucocitos < 10 × 109/l y plaquetas ≤ 400 x 109/l) en la semana 80.
Con un seguimiento del estudio a 5 años, se ha observado respuesta duradera en cuanto a control del hematocrito en 16 de 74 pacientes (22%) y respuesta hematológica completa mantenida en 9 de 74 pacientes (11%). Estos parámetros no se han podido evaluar en el grupo de MTD ya que no hubo pacientes desde la semana 80.
Referencias:
1. Passamonti F, et al. Lancet Oncol 2017 Jan; 18: 88–99
2. Passamonti et al Lancet Hematology 2022; May 18, 2022.
Seguridad
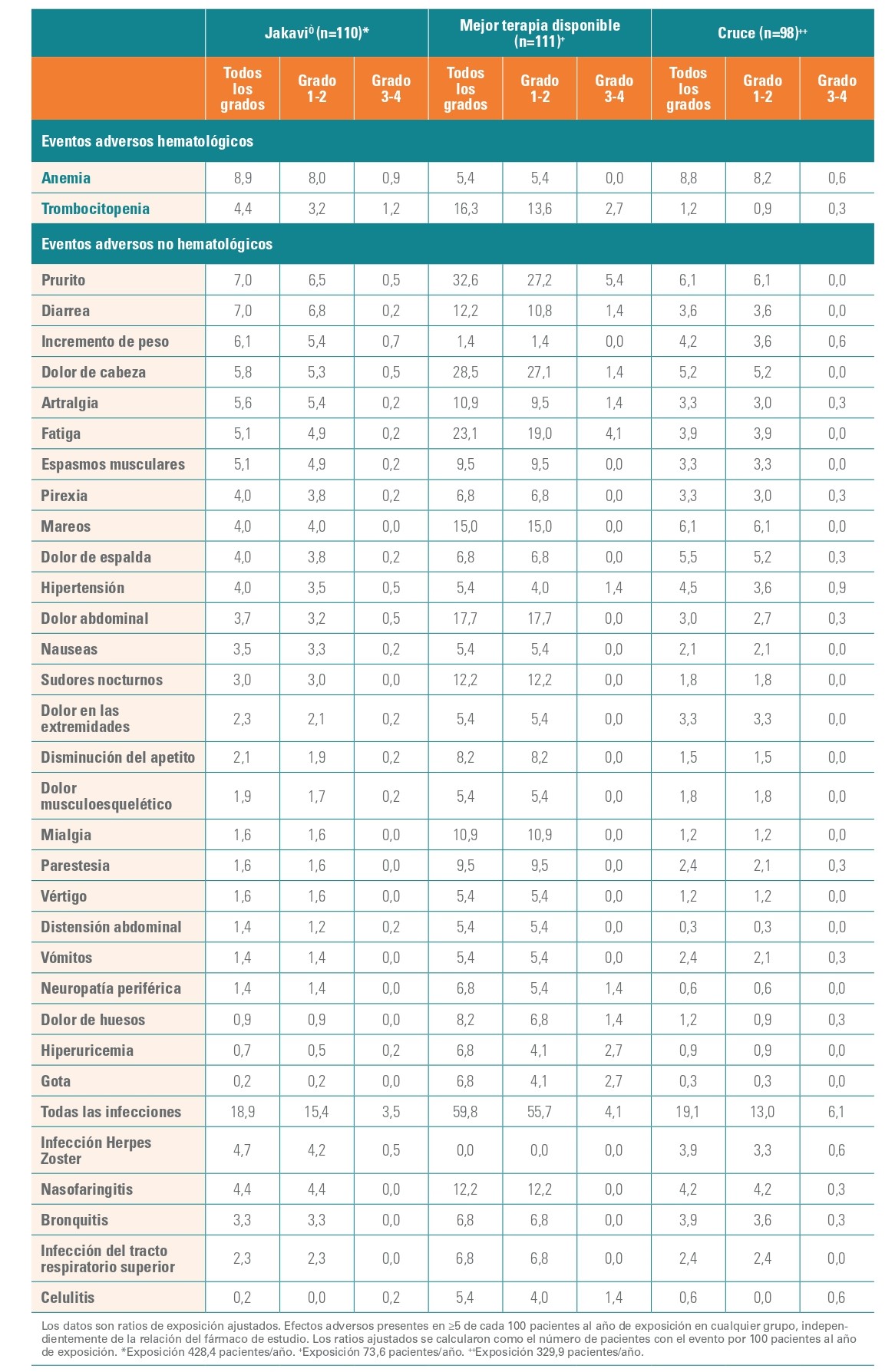
Acontecimientos adversos no hematológicos y hematológicos
Las tasas de eventos adversos no hematológicos fueron, en general, menores en el grupo tratado a largo tiempo con Jakavi que en el grupo tratado con MTD.
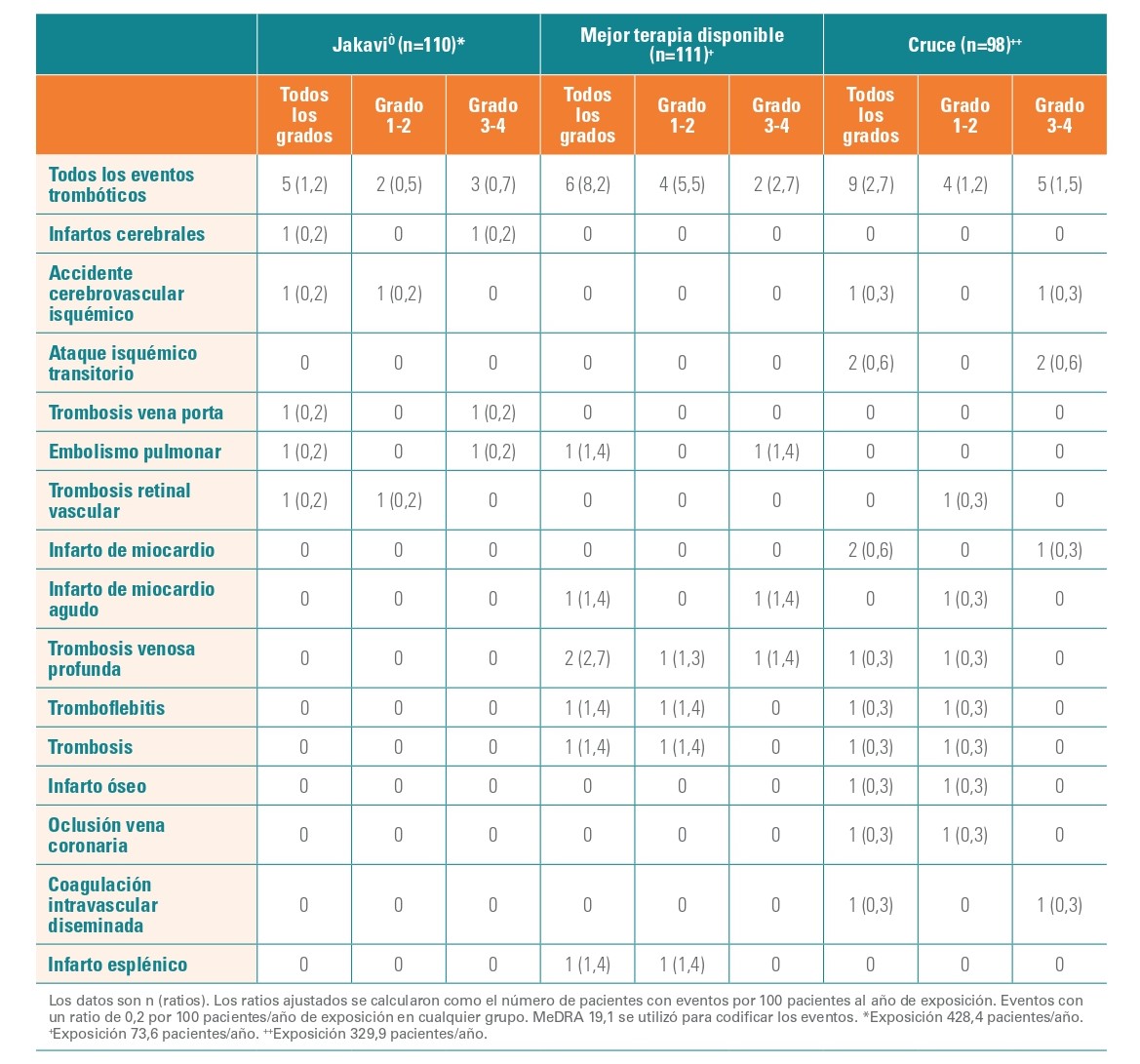
Tasas de eventos tromboembólicos
Referencias:
1. Kiladjian JJ, et al. Lancet Haematol. 2020 Mar;7(3):e226-e237.
Acontecimientos adversos
Los datos están ajustados por pacientes-año de exposición, con independencia de la relación con el fármaco del estudio (todos los grados, ≥5% en cualquier grupo).
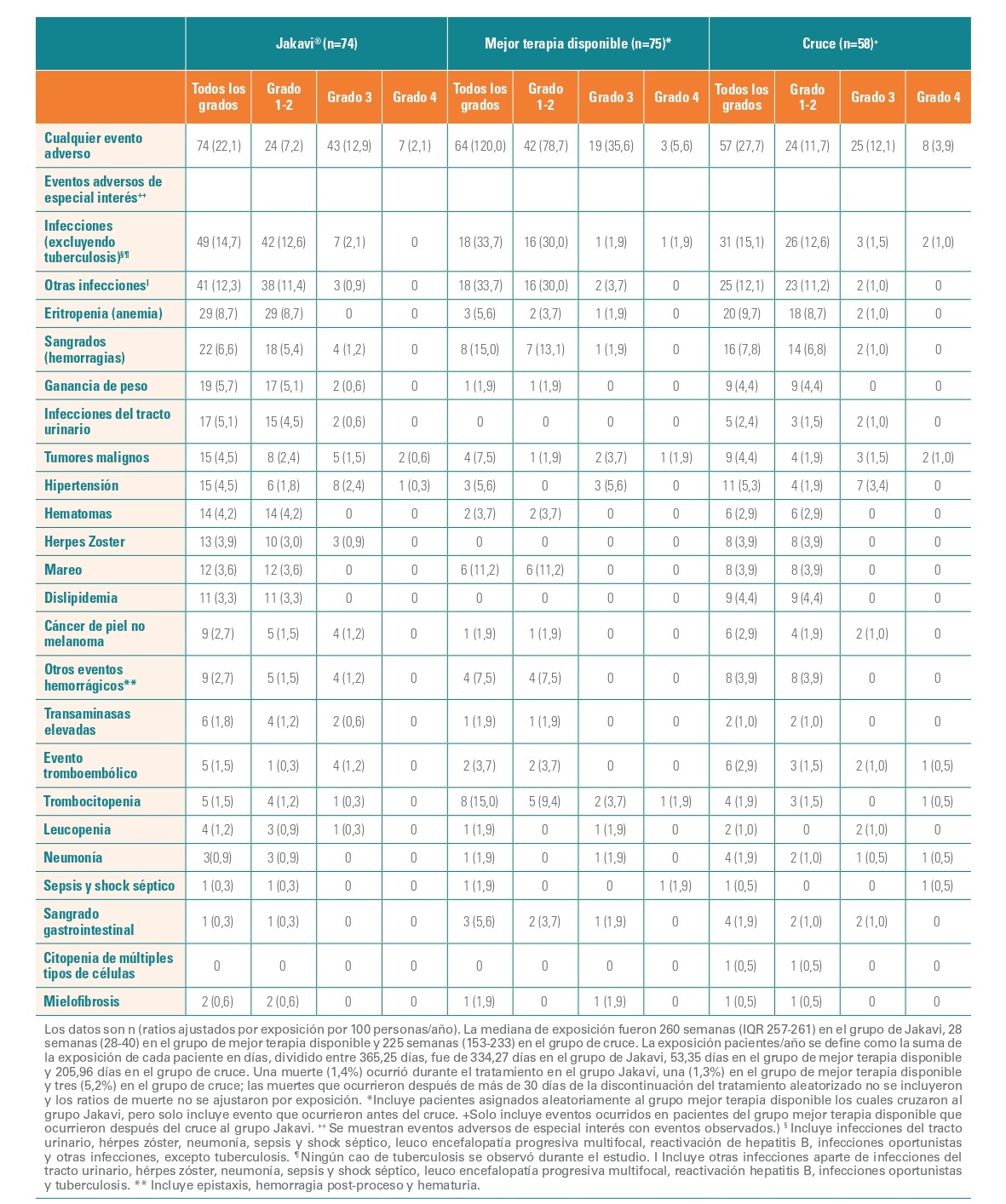
Reacciones adversas reportadas en ficha técnica
Las reacciones adversas hematológicas (de cualquier grade CTCAE) incluyeron:
- Anemia (61,8%) - (2,9% de grado 3 o 4).
- Trombocitopenia (25,0%) - (2,6% de grado 3 o 4).
Las reacciones adversas no hematológicas más frecuentes fueron:
- Aumento de peso (20,3%).
- Mareo (19,4%).
- Dolor de cabeza (17,9%).
Las alteraciones de valores de laboratorio no hematológicas más frecuentes (de cualquier grado CTCAE) identificadas como reacciones adversas fueron:
- Aumento de alanino aminotransferasa (45,3%).
- Aumento de aspartato aminotransferasa (42,6%).
- Hipercolesterolemia (34,7%).
El 19,4% de los pacientes suspendieron el tratamiento debido a los efectos adversos independientemente de su causalidad.
Referencias:
1. Passamonti F, et al. Lancet Oncol 2022.
2. Ficha técnica de Jakavi® (ruxolitinib). Disponible en: https://cima.aemps.es/cima/dochtml/ft/112773015/FT_112773015.html
Con receta Médica. Diagnóstico Hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los Hospitales; por lo tanto irá desprovisto de cupón precinto. PVLn Jakavi 10 mg 56 comprimidos 3.583,33 €. PVLn Jakavi 15 mg 56 comprimidos 3.583,33 €. PVLn Jakavi 20 mg 56 comprimidos 3.583,33 €. PVLn Jakavi 5 mg 56 comprimidos 1.791,66 €.



