El origen de la ECF radica en una mutación en el gen que codifica para la beta hemoglobina, y que supone una sustitución de ácido glutámico por valina en la posición 6 de su cadena aminoácídica.1 La hemoglobina resultante presenta, por tanto, un exceso de cargas positivas en sus cadenas beta, y recibe el nombre de hemoglobina S (HbS).1
Cuando se libera el O2 de la HbS, las terminaciones hidrofóbicas de la valina quedan expuestas y para estabilizarse forman enlaces con aminoácidos de otras moléculas de HbS adyacentes, de forma que van polimerizando y formando cadenas cada vez más largas en el interior del eritrocito, que terminan por alterar su morfología y características estructurales y funcionales.1
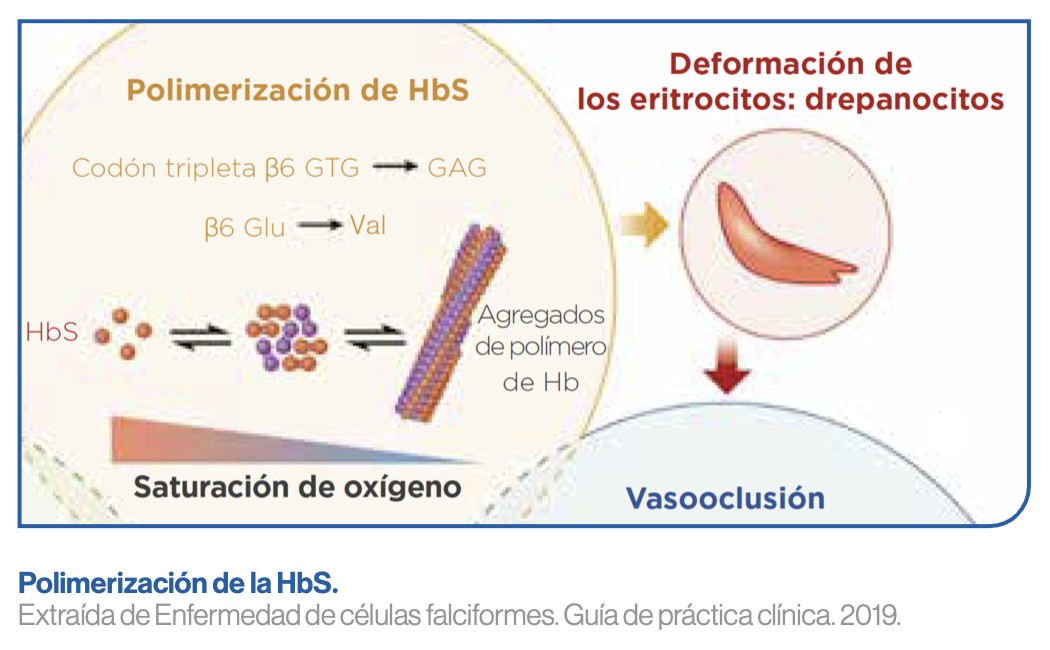
Cuando la hemoglobina se vuelve a oxigenar los enlaces entre moléculas de HbS se rompen y el eritrocito recupera su forma normal, aunque con el tiempo el proceso deja de ser reversible, y los eritrocitos adquieren la morfología falciforme de forma permanente.1
Los eritrocitos falciformes se forman mayoritariamente en el bazo, dado que es el lugar en el que se alcanzan mayores niveles de desoxigenación de la HbS.1 Por ello son frecuentes los infartos esplénicos de repetición y los pacientes terminan padeciendo una autoesplenectomía a los 4-5 años de edad.1 Esta asplenia funcional, característica de los pacientes con ECF, hace que estos pacientes sean especialmente sensibles a algunos tipos de infecciones, como las causadas por gérmenes encapsulados.1
La polimerización de la HbS también desencadena en el eritrocito una serie de reacciones bioquímicas intracelulares que oxidan diferentes componentes celulares, entre los que se encuentran algunas proteínas de membrana. Esas proteínas de membrana oxidadas son reconocidas por el sistema inmune y los eritrocitos acaban siendo fagocitados por macrófagos. Por ello, otro de los fenómenos característicos en los pacientes con ECF es la hemólisis extravascular.1
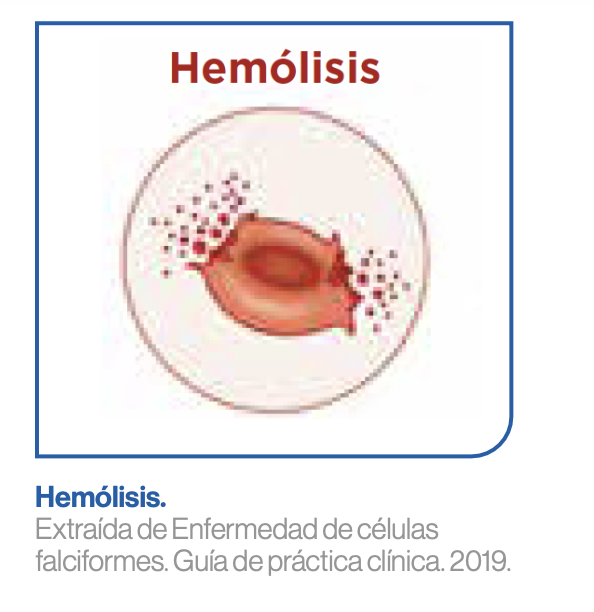
Además de la hemólisis extravascular como consecuencia de la fagocitosis de eritrocitos falciformes en bazo, hígado y médula ósea, se produce también una hemólisis intravascular, debida a los estímulos mecánicos y oxidativos a los que se ven sometidos los eritrocitos falciformes en el torrente circulatorio.1
La activación del sistema inmune como consecuencia de todo lo anterior desencadena reacciones inflamatorias y la liberación de citoquinas y otras moléculas de señalización que acaban favoreciendo la adhesión entre eritrocitos, leucocitos y plaquetas y con la superficie endotelial.1 Los agregados celulares resultantes disminuyen la velocidad del flujo sanguíneo favoreciendo la desoxigenación de la HbS y la formación de nuevos eritrocitos falciformes. Todo ello tiene como consecuencia la obstrucción de vasos sanguíneos o vasooclusión, dando lugar a las denominadas crisis vasooclusivas (CVO) características de la enfermedad.
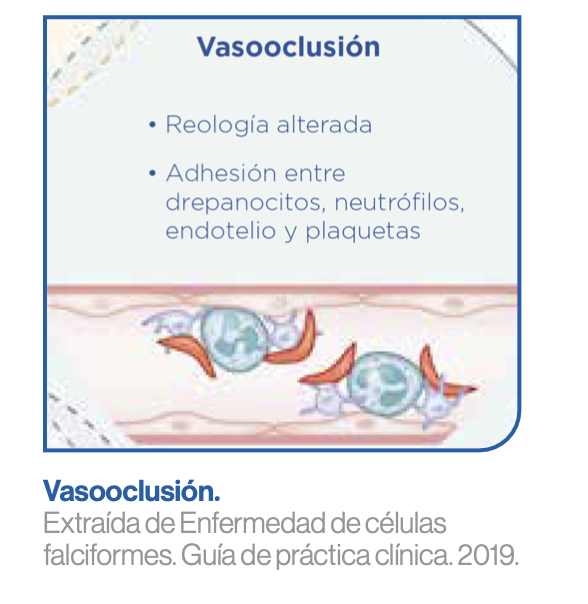
Las CVO acaban produciendo un daño endotelial crónico como consecuencia de fenómenos repetidos de isquemia-reperfusión que, junto a la liberación de productos eritrocitarios por la hemólisis intravascular, generan un estado de inflamación sostenida.1 Así, se forma un bucle de retroalimentación positiva en el que la enfermedad progresa dando lugar a daños crónicos a nivel orgánico como vasculopatía de pequeño vaso en el sistema nervioso central, disfunción diastólica del ventrículo derecho e hipertensión pulmonar, retinopatía diabética o hemorragia vítrea e insuficiencia renal.1
Referencias:
1. Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.



